Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 27. 10. 2011 18:54
acidita
prosím o pomoc stímto příkladem:
Alikvotní podíl 100 ml roztoku vzorku obsahujícího směs kyseliny sírové a siřičité si vyžádala při titraci 0,1N-roztokem NaOH spotřebu 30,0 ml; tato neutralizační titrace stanovuje tedy sumu obou kyselin :
H2SO4 + H2SO3 + 4 NaOH = Na2SO4 + Na2SO3 + 4 H2O
Stejný alikvotní podíl, tedy opět 100 ml vzorku při titraci 0,05N-odměrným roztokem jodu( používá se roztok jodu v jodidu: I2 + I- = I3- ) si vyžádal spotřebu 20,0 ml; tato oxidačnítitrace tedy stanovuje pouze kyselinu siřičitou:
1 H2SO3 + 1 I2 + H2O = 1 H2SO4 + 2 I- + 2 H+
Vypočítejte aciditu vzorku vyjádřenou počtem mq (tedy počtem m mol H+), obsažených v
1000 ml vzorku. Dále vypočítejte počet m mol kys. siřičité, které jsou obsaženy v 1000 ml
vzorku a dále počet m mol kys. sírové, které jsou obsaženy v 1000 ml vzorku (tento počet je
roven rozdílu : celkový počet mmol obou kyselin mínus počet mmol kys. siřičité). Vypočítejte
také počet mg H2SO4 a H2SO3 obsažených v 1000 ml vzorku.
nevím si rady hlavně s aciditou zbytek pravděpodobně vypočítám.. děkuji předem za odpověd
Offline
#2 27. 10. 2011 20:49
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: acidita
Opět pozdrav,
cíl:
Vypočítejte aciditu vzorku vyjádřenou počtem mq (tedy počtem m mol H+), obsažených v
1000 ml vzorku.
analyzuješ vzorek "směs kyseliny sírové a siřičité" - první reakce umožňuje vypočítat celkové množství H+ ve směsí, druhá reakce je selektivní na kyselinu siřičitou. Kterou reakci tedy zvolíš pro výpočty acidity? Děkuji.
Offline
#4 30. 10. 2011 10:56
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: acidita
↑ vaseiva:
děkuji, mně to tak nevychází. Jak jsi přepočetla 0.1 N na molární koncentraci roztoku NaOH a na látkové množství? Uvažovala jsi potom, že jeden mol H2SO4 reaguje s 2 mol NaOH (a stejně pro H2SO3)?
-----------------------------------------------------------------
OT: nový text nad oknem zprávy zaznamenán, děkuji autorovi, editor mám vypnut - je to na mne moc pestré a málo prostoru, ovšem pro pořádek v tématech velký krok, děkuji :-)
Offline

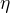 * k (vzoreček ze semináře
* k (vzoreček ze semináře