Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 20. 02. 2013 21:40 — Editoval alofokolo (20. 02. 2013 21:43)
Výpočty z chemických rovnic
Dostali jsme za domácí úkol příklad : Kolik gramů oxidu uhelnatého vznikne reakcí 50 gramů uhlíku s kyslíkem?
Příklady na výpočty jsme procvičovali pouze na jednom příkladu, který byl odlišný od tohohle (Kolik gramů jódu vznikne reakcí dvou gramů jodidu draselného s chlórem?) a dal se snadno vypočíst.
Procvičený příklad:
M(2KI) = 166 X 2= 332g/mol
M(2Cl) = 35.5 X 2= 71g/mol
M(2I) = 127 X 2 = 254g/mol
Z toho vznikne trojčlenka a výpočet : 
508 = 332x
Druhý příklad je ale jiný, a nevím si s ním rady. Kdyby jste mi vysvětlili, jaký je mezi nimi rozdíl a jak se to počítá, byl bych moc rád :) (úkol je až na pátek)
Offline
- (téma jako vyřešené označil(a) alofokolo)
#2 20. 02. 2013 23:21
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočty z chemických rovnic
Zdravím,
pokud projdeš odkazy "výpočty z chemických rovnic", například, tak vidíš, že řešení třeba začínat sestavením chemické rovnice a vyčíslením chemické rovnice - to se podařilo pro novou úlohu?
V 1. úloze jste také sestavili a vyčíslili rovnici: 2KI+Cl2->I2+2KCl.
Potom jste řekli, že z 2 mol KI vzniklo 1 mol I2 dle reakce, ale my máme dle zadání 2 g KI. Tedy mám možnost převést moly na gramy přes molární hmotnost a řekneme, že:
z 2*M_r(KI) vzniklo 1*M_r(I2)
z 2 g (KI) vzniklo x g I2
-----------------------------------
v každém řádku teď mám jednotky hmotnost. Je všemu rozumět? Potom se podíváme na další postup (když až do pátku :-)
Jinak:
M(2KI) = 166 X 2= 332g/mol
M(2Cl) = 35.5 X 2= 71g/mol
první řádek dává výpočet hmotnosti 2 mol KI, ale druhý řádek dává výpočet hmotnosti 1 mol Cl_2 (molekula Cl má 2 atomy), jestli v tom nemáš zádrhel.
Offline
#3 21. 02. 2013 18:49
Re: Výpočty z chemických rovnic
Rovnice bude : 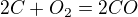 je to tak?
je to tak?
Jinak nevím, jak převést moly na gramy přes molární hmotnost, když jednotka molární hmotnosti je gram/mol. Když mám zadánu hmotnost uhlíku, (50g) tak z ní dokážu vypočítat jedině látkové množství (n), ale nevím, na co to budu potřebovat. Prosím o vysvětlení toho převádění, nějak jsem to nepobral :). K tomu chlóru - ano vím, je to dvouatomová molekula. Když píšu Značku molární hmotnosti a do závorky za ní Cl, tak to má být takhle 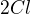 nebo takhle
nebo takhle 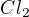 ? U tohoto příkladu si nevím dál rady, Potřeboval bych jej spočítaný tak do 7:00 zítra ráno, kdyby jste byli tak hodní :). Paní učitelka si tento příklad vymýšlela, když nám ho dávala, takže si nejspíš v rychlosti neuvědomila, že jsme takový typ příkladu nebrali, a podle toho to taky zítra ráno dopadne :) .
? U tohoto příkladu si nevím dál rady, Potřeboval bych jej spočítaný tak do 7:00 zítra ráno, kdyby jste byli tak hodní :). Paní učitelka si tento příklad vymýšlela, když nám ho dávala, takže si nejspíš v rychlosti neuvědomila, že jsme takový typ příkladu nebrali, a podle toho to taky zítra ráno dopadne :) .
Offline
#5 22. 02. 2013 00:15 — Editoval jelena (22. 02. 2013 00:53)
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočty z chemických rovnic
↑ alofokolo:
rovnice a výpočet je v pořádku (výpočet je trošku nepřehledný).
Pro převod látkového množství (mol) na hmotnost (gramy) můžeš používat vzorec 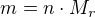 (n je látkové množství (zde 2 mol),
(n je látkové množství (zde 2 mol),  je molární hmotnost pro C je 12 g/mol). Nebo trojčlenku.
je molární hmotnost pro C je 12 g/mol). Nebo trojčlenku.
Také můžeš převést zadanou hmotnost uhlíku m=50 g na látkové množství: 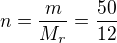
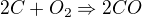 k této reakci bych zapsala:
k této reakci bych zapsala:
z 2 mol C vzniká 2 mol CO
z 50/12 mol C vzniká x mol CO
----------------------------------------
pomocí trojčlenky (přímá úměra) mám  , přepočteno na hmotnost CO
, přepočteno na hmotnost CO 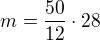
---------------------------------------------------------
Můžeš rovnou sestavovat trojčlenku v požadovaných jednotkách:
z 2*12 g C vzniká 2*28 g CO
z 50 g C vzniká y g CO
---------------------------------------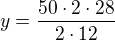
Záměrně jsem nic nevykrátila, aby bylo vidět, jak lze celý výpočet sestavit rovnou.
Ve výsledku se shodujeme.
EDIT. děkuji za opravu, M_r(CO)=28
Offline
#7 22. 02. 2013 00:54
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočty z chemických rovnic
↑ alofokolo:
děkuji, určitě má být :-) - opraveno.
Offline


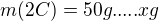
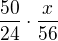 =
=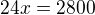

 tohle
tohle