Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
Stránky: 1 2
- Hlavní strana
- » Ostatní
- » Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie) (TOTO TÉMA JE VYŘEŠENÉ)
#1 26. 12. 2009 23:50 — Editoval jelena (06. 07. 2013 00:03)
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
Zdravím všechny příznivce chemie, pokouším se vyřešit tohle:
Problém je samozřejmě hlavně v tom, že obou termínům od "e" moc nerozumím, nicméně moje původní ambice všechno pochopit postupně degradovala až ke snaze nějak proplout, takže bych byl vděčný i za samotnou správnou odpověď :-)
Offline
- (téma jako vyřešené označil(a) jelena)
#2 27. 12. 2009 00:39
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
Zdravím,
řekla bych, že zda reakce probíhá nebo ne, se má posuzovat podle změny G - pokud klesá, reakce probíhá, pokud stoupá, reakce neprobíhá. Volila bych 4. odpověď. Váš materiál - str. 50. Může být?
:-) Nemohlo by být něco na výpočet trojčlenkou?
Offline
#3 27. 12. 2009 00:57
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Tu trojčlenku právěže zdá se docela zvládám :-). S růstem volné entalpie to bude pravda, je to ale další položka na seznamu "naučit se nazpaměť," protože ani se znalostí její definice bych to nevymyslel...ale co se dá dělat. Tak děkuju!
Offline
#4 27. 12. 2009 01:12
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
škoda trojčlenky - mohli bychom konečně kolegům osvětlit, jak to je. Chemii určitě proplůješ - když jsem já zvladla nosniky a politickou ekonomii (ta byla, myslím, horší, než nosniky - 33. kritika odpůrců odpůrců jiných odpůrců... jediná zkouška, kterou jsem nesložila napoprve).
Pokud ještě něco máš z chemie, tak se ptej a nahlas termín na držení palců :-)
Offline
#5 27. 12. 2009 15:26 — Editoval FliegenderZirkus (27. 12. 2009 15:51)
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
To je taky pravda, radši se učit chemii než dějiny mezitřídního boje. Test mě čeká 5.ledna, což je sice docela daleko, jenže na Silvestra a sousední tři dny nebudu doma a o intenzitě studia na chatě se spolužáky z gymplu nemám iluze :-).
Snad nebude vadit, když další dotazy napíšu do tohoto vlákna, moc jich doufám nebude :-).
Clapeyronovu rovnici jsem našel ve skriptu a vypadá podezřele podobně jako ta zadaná, jenže to růžové podbarvení znamená, že odpově´d je špatně..
Offline
#6 27. 12. 2009 15:59
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
Jestli to není jen nešťastně formulovana otázka? - nebot v učebnici Fyzikální chemie pro SPŠ chemické (ziskané při likvidaci starých učebnic na jedne skole v Ostravě) se píše: rovnice Clapeyronova (je uvedena 1. rovnice)... a předpokládá, že se pára chová jako ideální plyn (V_m=RT/p). Takto dospíváme k rovnici Clausiově-Clapeyronově: (je uvedena 2. rovnice).
Já bych této otázce rozuměla, že první rovnice "za předpokladu ideálního chování plynnné fáze" tedy se upraví na zápis 2. rovnice a až taková upravená rovnice bude "Clausius-Clapeyronova rovnice pro vypařování a kondenzaci" (tedy 5. odpověď). Ale bez učebnici ta jejich formulace je nerozluštitelná.
OT: alespoň na chatě mužeš, jako "chemik" - využit tohoto poznátku, o kterém diskutuji s kolegou O.o - on se tady teď moc neobjevuje, jelikož je velmi zaměstnan studiem chemie na VŠCHT a práci na nějakém jejich ústavu (ale případně ho můžeš potkat v "modré menze").
Offline
#7 27. 12. 2009 17:03
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
To bude ono, chce to číst pořádně zadání...jako vždy. Takový trojčlenkový fanatik zase nejsem, abych ji používal na Silvestra :-).
Offline
#8 27. 12. 2009 21:10
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
Narazil jsem na další nejasnost:
Už vím, že v adiabaticky izolované soustavě bude reakce probíhat samovolně, pokud entropie poroste nebo se nebude měnit, takže se rozhoduju mezi první a druhou možností, jenže o změně entalpie toho moc říct nemůžu, nebo ano?
Offline
#9 27. 12. 2009 21:44
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
Já nevím, zda neberu kolegům přiležitost se rozvinout v takto zajimavém směru :-)
Když se rozhodujeme mezi 1) a 2), tak si řekneme, že teplo musí být do soustavy uvolňovano (nebo v izolované soustavě není kde sebrat), proto  musí být záporné (reakce exotermická) a volila bych odpověď 2. Může být?
musí být záporné (reakce exotermická) a volila bych odpověď 2. Může být?
Offline
#10 27. 12. 2009 21:58
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Mě popravdě vůbec nenapadlo, že H tady značí reakční teplo a ne entalpii, proč to tam proboha nenapíšou? :-) Písmenek v abecedě je na současný stav vědy moc málo, kromě řecké abecedy a latinky by to asi chtělo pro různé veličiny výrazněji využívat třeba azbuku :-).
K problému: moc děkuju za polopatické vysvětlení, takhle tomu rozumím, když do soustavy nesmím přivádět teplo, tak mi žádná endotermická reakce neproběhne.
Offline
#11 27. 12. 2009 22:00 — Editoval O.o (27. 12. 2009 22:01)
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Zdravím moji oblíbenkyni -),
možná kolegovi pomůže najít si něco ke Gibbsově energii, určitě dojde ke správnému výsledku (také tuším, že druhá možnost, ale na fyzikálu se budu dívat až za tři týdny, teď je tu biochemie ;-)).
OT:
Zavítal jsem na moment zpět na forum, tak se ještě zeptám, jaký je stav studentky z emailové konverzace? Které zkoušky jsou hotové, na ketré se připravuje, atp..? Kdyby něco, určitě si vzpomenu na pár tipů.. ^.^
EDIT:
↑ FliegenderZirkus:
Reakční teplo je takové nepřesné, ale vžité, označení po entalpii, takže v zadání byla opravdu entalpie ;-).
Offline
#12 27. 12. 2009 22:24
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ O.o:
Tušil jsem, že spolu ty dva pojmy nějak souvisejí, ale ne takhle úzce, díky za objasnění :-).
Offline
#13 27. 12. 2009 22:56
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ O.o:
Také vřelý pozdrav, zrovna v tomto tématu jsi byl vzpominán (pozitivně, jak jinak :-)
Můžeš být v klidu - kolega je teoreticky vybaven, vnitřně odhodlan a všemožně podpořen (dokonce jsem se probudila, když měl problém s elektrolýzou). Navíc kolega má jen samá pozitiva - je budoucí strojář s kladným vztahem k hudbě a trojčlence (k ostatní matematice také, ale to je trochu nad rámec mého posuzování).
Pobytová studentka si vede dobře - z chem. výpočtů má dobré body, s názvoslovím bojuje, ale snad to také uvalčí, matematiku si asi rozloží na delší období (když uvážím, že k tomu ještě pracuje na plný úvazek a po věčerech vyučuje jazyky, tak by měla být vzorem pro velkou řadu místních uživatelů). Z vaších sbírek má vypočtený opravdu každé zadání, nekteré i opakovaně. Má samozřejmě výhodu - když se zasekne, tak jsem na dosah.
Do fyzchemie a biochemie hodně zdaru - asi bych nechtěla ani jedno (i když to tak pěkně s kolegou opakuji, dokonce jsem vytahla Moore "Fyzikální chemie", co má přes 950 str., ale ještě nebylo potřeba, zatím se držím nebo si vystačím s učebnici pro SPŠ chemické :-)
V některých tématech to ovšem vypadá... Mějte se hezky :-)
Offline
#14 03. 01. 2010 23:31
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Velmi opoždědě děkuji za důvěru a za milá slova. :-)
Chtěl jsem název vlákna změnit na "Základy fyzikální chemie," ale nenašel jsem jak, přesto další dotaz pošlu sem, za matoucí titulek se omlouvám. Jestli někdo budete mít čas, zkontrolujte mi prosím tenhle postup, přijde mi nějak podezřelý a správný výsledek bohužel neznám.
Nejdřív si zvolím látkové množství, nějaké ![kopírovat do textarea $n_0[\mathrm{kmol}]$](/mathtex/3e/3ec2144bed2c01a73bfd5dc00c080fba.gif) , potom spočítám hmotnosti složek:
, potom spočítám hmotnosti složek: ,
, ,
,
hmotnost soustavy potom bude:![kopírovat do textarea $m_S=m_{\mathrm{O_2}}+m_{\mathrm{N_2}}=6,72n_0+22,12n_0=28,84n_0 [\mathrm{kg}]$](/mathtex/41/4172122c826f329d03e8e67292746815.gif) ,
,
pokračuju objemem:![kopírovat do textarea $V=\frac{m}{\rho}=\frac{28,84n_0}{0,666}=43,3n_0[\mathrm{m^3}]$](/mathtex/0a/0a0e31e7ae3e3b10026ce6130bc0754f.gif) ,
,
ze stavové rovnice ideálního plynu dostanu:![kopírovat do textarea $T=\frac{p\cdot V}{n\cdot R}=\frac{150000\cdot 43,3\cdot n_0}{n_0\cdot 8314}=781,212 [\mathrm{K}]$](/mathtex/d9/d9f2749ac768846e656e3279b9e7bc48.gif) .
.
Nejde to spočítat méně krkolomně, pokud je to vůbec takhle správně? Připadá mi to jako počítatání obsahu čtverce integrálem :-). Předem děkuju za odpovědi!
Offline
#15 04. 01. 2010 00:40 — Editoval jelena (04. 01. 2010 00:44)
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
Zdravím, já to ještě v rychlosti napiši - termín se bliží :-)
Ideově se to zdá být v pořádku - u těchto úloh vždy se dá zvolit nějaké "jednotkové množství" - 1 litr, 1 kg 1 mol směsí. Já bych zvolila jako výchozí jednotkový objem směsi=1..., dopočtu hmotnost směsí (je to rovnou hustota, pokud zvolím dobré jednotky objemu) a přes objemové koncentrace dopočtu molární složení směsí. To je vlastně jediné, co opravdu počítám - molární hmotnost směsí.
Ve vašem materiálu je to na závěr cvičení 2.7 (způsob řešení C 3). Objemové koncentrace pro ideální plyny můžeme použit dle úmluvy (také ve vašim materiálu na závěr str. 6 (způsob řešení B 1).
Zkus to ověřit, zda je to rychlejší a přeji pohodový vstup do nového roku :-)
Offline
#16 04. 01. 2010 00:51
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Aha, to je pravda, se zvoleným objemem to bude jednodušší. Po několika desítkách molů 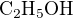 z předchozích dnů se ani nedivím, že mě to nenapadlo. :-) děkuju za pomoc v každé fázi dne i noci
z předchozích dnů se ani nedivím, že mě to nenapadlo. :-) děkuju za pomoc v každé fázi dne i noci
Offline
#17 04. 01. 2010 21:53
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
Dobrý večer, z 280 vzorových otázek řeším posledních pár nejasností z termodynamiky, snad se zítra zadaří. Řešili jsme tu už úlohu: ,
,
jenže ve dvou náhodně generovaných testech, ve kterých jsem na ni narazil, jsem zvolil druhou a čtvrtou možnost jakožto hlavní podezřelé na správnou odpověď a obě jsou špatně, což se mi nějak nezdá, možná jde jen o chybu v testu, ale pro jistotu se ještě ptám.
Druhý problém souvisí s definicí entalpie:
hledal jsem v přednáškových prezentacích, ale neúspěšně. Pokud by šlo o izochorický děj, tak by člen pdV vypadl a zbylo by dU=dH, to nevypadá moc pravděpodobně...je to správná stopa? Předem děkuji
Offline
#18 04. 01. 2010 22:09
- Pavel Brožek


- Místo: Praha
- Příspěvky: 5694
- Škola: Informatika na MFF UK
- Pozice: Student
- Reputace: 194
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
K 5.: Když diferencujeme známý vztah 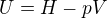 , dostaneme
, dostaneme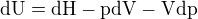
Řekl bych tedy, že ten tvůj platí pouze při izobarickém ději. Ale nevím, jestli mi můžeš věřit, dnes jsem psal test z termodynamiky a nespočítal jsem potřebné množství příkladů na zápočet :-).
Offline
#19 04. 01. 2010 22:35
- FliegenderZirkus

- Příspěvky: 544
- Škola: RWTH Aachen
- Reputace: 25
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ BrozekP:
Dík, to bude ono. Náš test s tím vaším asi co do obtížnosti nejde moc srovnávat, takže můžu jenom popřát hodně štěstí na další pokus.
Offline
#20 04. 01. 2010 23:34
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
Zdravím, 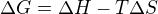 - když uvážím toto, že
- když uvážím toto, že  musí být záporné, aby reakce probíhala samovolně,
musí být záporné, aby reakce probíhala samovolně, 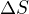 musí být kladná, tak
musí být kladná, tak  může být kladné, ale musí být měnší, než to, co se odečitá - proto to není definitivně jednoznačna odpověď, ovšem pro
může být kladné, ale musí být měnší, než to, co se odečitá - proto to není definitivně jednoznačna odpověď, ovšem pro  záporné je splněno všechno - tedy bych volila odpověď 2 (nebo 4). jediné, co je mi podezřelé - že v jednom testu maji k nabídce obě odpovědi, co považujeme za vyhovujicí - obě asi nejdou zaškrtnout.
záporné je splněno všechno - tedy bych volila odpověď 2 (nebo 4). jediné, co je mi podezřelé - že v jednom testu maji k nabídce obě odpovědi, co považujeme za vyhovujicí - obě asi nejdou zaškrtnout.
početla jsem Moore i tuto debatu, ale nedošla bych na jiný závěr, než co jsem napsala.
Budeme doufat, že to zachrániš trojčlenkou.
Jinak jsem postřehla, že jsi zcela správně pochopil princip chemické přípravy - zákony zachování + "Co nejde vysvětlit přes kuchyňskou sůl a etanol, nemá smysl vysvětlovat". Zitra hodně zdaru :-)
pro kolegu Pavla B. - před dalším testem budu muset aplikovat výchovný prostředek (případně spojim své sily s kolegou Lukášem - tvoříme takový výchovný tým dle ohlasů), abys hledel do vhodné knihy, ale ne do elektrotechniky - je zřejmé, že již jsi byl docela vyčerpán - nebo jiný důvod ke zmeně identity. Pozdrav :-)
Offline
#21 04. 01. 2010 23:40 — Editoval BrozekP (04. 01. 2010 23:44)
- Pavel Brožek


- Místo: Praha
- Příspěvky: 5694
- Škola: Informatika na MFF UK
- Pozice: Student
- Reputace: 194
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
Zdravím, tak to dopadá, když píšu v rychlosti a nepřečtu si to po sobě. Teď mě to praštilo do očí, díky za upozornění :-)
Když už jsme v tom mírném OT, tak nevěděla bys o nějakém elektronickém zdroji, kde by byly formálně zavedeny potenciály a podobné věci? Hrozně se v tom ztrácím.
Offline
#22 04. 01. 2010 23:51
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ BrozekP:
pravopis samozřejmě nebyl myšlen vážně (to bych měla číst své háčky a čárky :-)
Jak mysliš zavedeny potenciály - jako definice nebo jak?
Offline
#23 04. 01. 2010 23:56 — Editoval BrozekP (04. 01. 2010 23:58)
- Pavel Brožek


- Místo: Praha
- Příspěvky: 5694
- Škola: Informatika na MFF UK
- Pozice: Student
- Reputace: 194
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ jelena:
To ne, definice a vztahy, to je všechno na wikipedii (a snad je dám i dohromady z magického čtverce). Mně chybí nějaké pochopení. Já vlastně nevím, co přesně chci :-) No tady to nebudeme řešit, pokud dokážu upřesnit svůj dotaz, tak si založím téma.
Offline
#24 05. 01. 2010 00:19
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ BrozekP:
tak až rozmysliš :-)
My máme knihu Moore Fyzikální chemie, české vydání 1981 (950 s), čte se dobře, ale dlouho - v ni se to odvozuje pomoci Legendrových transformací (ale já jsem to vždy brala jako hotovou věc - hotové 4 vztahy + další odvození).
Citát ze závěru kapitoly o potenciálech: "Ukázali jsme snad na již dostatečném počtů příkladů, jakými způsoby lze termodynamické funkce nejen odvozovat, ale i kombinovat a dostávat tak úžasnou rozmanitost výrazů a vztahů, jež přináší - jak bychom mohli říci slovy Guy de Maupassanta - i radost, i užitek. Termodynamické potenciály a několík nejdůležitějších vztahů, jež pro ně platí, uvádíme v tab. 3.1 "
Mějte e pěkně :-)
Offline
#25 05. 01. 2010 01:03
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie)
↑ FliegenderZirkus:
chemická fakulta MGU potvrzuje 2. odpověď - jedině tam maji jednoznačně ДА.
Offline
Stránky: 1 2
- Hlavní strana
- » Ostatní
- » Základy fyzikální chemie FS ČVUT (entropie, entalpie, volná entalpie) (TOTO TÉMA JE VYŘEŠENÉ)