Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 12. 01. 2012 16:40 — Editoval martin21 (12. 01. 2012 16:44)
elektrolýza
Zdravím, potř. bych helpnout s tímto příkladem
Za jakou dobu se z 250g roztoku síranu měďnatého o hmotnostním obsahu 5% CuSO4 vyloučí proudem 1,5A veškerá meď?
Hmotnost čistého CuSO4 bude tedy 12,5g ..... pak jsem zkoušel aplikovat vzorec m = (M*Q)(z*F) a vyšlo mi 33min, mělo by vyjít ale 2h 47min
Kde tedy dělám cyhbu? díky moc za odpověď
Ještě doplním, že z=2
Offline
- (téma jako vyřešené označil(a) jelena)
#3 12. 01. 2012 17:12 — Editoval smatel (12. 01. 2012 17:17)
Re: elektrolýza
Ahoj.
Hmotnost roztoku je 250g, síranu je tam 5%. Hmotnost síranu je tedy: 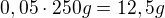 .
.
Hmotnost čisté mědi, která se vyloučí (tj. kolik gramů Cu obsahuje 12,5 g síranu), určíme pomocí poměru relativních hmotností mědi ku celému síranu: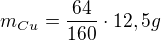
A nyní Faradayův zákon elektrolýzy: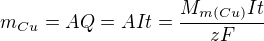
Odtud pro čas t: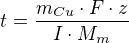
Dosadit ve správných jednotkách:
Offline
#5 12. 01. 2012 18:05
Re: elektrolýza
↑ mikrochip:
Zdravím. Moc dobře vím, jak problematické jsou příklady elektrolýzy. Je tam několik zádrhelů, kterých se studenti dopouštějí. Většinou je to ještě způsobeno trošku rozdílnými zvyky v chemii a fyzice. Proto jsem napsal celé řešení i s dosazením, protože moc dobře vím, jakou práci dá přijít na chybu, v tomto případě. Také je zde zřejmé, že tazatel se problémem už zabýval a počítal jej. Nevidím tedy důvod mu to sem nenapsat. :-)
K těm zádrhelům. Jsou tady určitě věci, které se ve fyzice a chemii vnímají trochu jinak, a pokud o nich student neví, může se do toho zamotat.
V chemici se většinou kouknou do periodické tabulky a vidí opíšou (třeba u kyslíku) číslo 16, přidají k tomu g/mol a řeknou, že je to molární hmotnost kyslíku (což je většinou ještě popularizováno "molární hmotnosti jsou v tabulce"). Fyzici však řeknou, že 16 je relativní hmotnost kyslíku a že po vynásobení 10^-3 kg/mol získají molární hmotnost kyslíku. Je to samozřejmě to samé, je tam akorát jiná jednotka a způsob konstatování, což je jasné člověku, který ví o co jde, ale ne každému studentovi, který se do problematiky teprve dostává. A to vím, o čem mluvím.
Ve vzorci:  se pak často dělají chyby, že za molární hmotnost se dosazuje relativní hmotnost, pak se nedosazuje hmotnost vylučovaného atomu prvku, ale celé disociované sloučeniny...
se pak často dělají chyby, že za molární hmotnost se dosazuje relativní hmotnost, pak se nedosazuje hmotnost vylučovaného atomu prvku, ale celé disociované sloučeniny...
Omlouvám se za částečný OT. :-)
Offline
