Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 31. 01. 2012 13:27
výpočet rychlostní konstanty
Zdravím,
mám problém s tímto příkladem :
Jistá reakce má Ea = 146 kJ mol−1. Jaká bude hodnota rychlostní konstanty při 100,0 °C, pokud při 25,0 °C je 4,25 ∙ 10−4s−1.
Převedla jsem teploty na Kelviny:
T(1) = 100 °C = 373,15 K
T(2) = 25 1°C = 298,15 K
Ea = 146 kJ*mol-1
A dosadila do tohoto vzorce:
k_1 = 4,3*10-4 s-1
Nevím, jestli to vyšlo správně, protože k tomu nemám výsledky a hlavně jsem si myslela, že by se měla ta aktivační energie dosazovat v joulech, ale to pak vycházelo jako dost velký číslo na rychlostní konstantu, tak jsem to dosadila v kJ.
Děkuji
Offline
- (téma jako vyřešené označil(a) Sydnney)
#2 31. 01. 2012 15:30
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: výpočet rychlostní konstanty
Opět pozdrav,
pokud jsi dosadila E v kJ, potom i R mělo být v kJ (bylo tak?). Vzorec se mi zdá být v pořádku, umístí sem, prosím odkaz na Wolfram, jak jsi dosazovala. Děkuji.
Offline
#4 31. 01. 2012 22:22
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: výpočet rychlostní konstanty
Omlouvám se, dřív jsem se k pořádnému překontrolování nedostala.
R = 8,314 (J/K*mol) - je to tak? Potom výsledek - odkaz.
V 2. úvodním tématu sekce jsou odkazy na materiály a na řešené úlohy z Fyzikální chemie - hodně podrobně, najdi si také orientační Van´t Hoff pravidlo - zde teplota stoupala o 75 stupňů, tedy nárůst rychlostní konstanty je orientačně (řadově) přibližně k1*2^(7) až k1*2^(8).
Tvůj výsledek je řadově stejný pro obě teploty, což by nebylo v pořádku.
Offline
#7 01. 02. 2012 09:35
Re: výpočet rychlostní konstanty
Ahoj,
jelena napsal(a):
...zde teplota stoupala o 75 stupňů, tedy nárůst rychlostní konstanty je orientačně (řadově) přibližně k1*2^(7) až k1*2^(8).
Na tomhle příkladu je dobře vidět jak je toto používané "pravidlo" (tj. při zvýšení teploty o 10 C vzroste rych. konst. 2x) spolehlivé. Rychlostní konstanta zde vzrostla řádově 100000x, zatímco podle odhadu měla vzrůst max. 256x.
Offline
#8 01. 02. 2012 09:38
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: výpočet rychlostní konstanty
↑ Sydnney:
děkuji :-) pravdu mají samozřejmě "Fyzikální tabulky".
Jednotka u rychlostní konstanty je závisla na řadu reakce>
- pro nultý řad je to mol/(l*s),
- pro první řad je to 1/s,
- pro n-tý řad je to l^(n-1)/(mol^(n-1)*s).
Souhlasí to se vzorcem pro výpočet rychlostní konstanty? Ve výpočtu, jak máš, jednotka konstanty bude stejná, jako té, co je zadána, jelikož řad reakce je pořád stejný.
Zde jsou také dobře řešené úlohy, jen se to nepohodlně prohlíží.
Offline
#9 01. 02. 2012 09:40
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: výpočet rychlostní konstanty
↑ zpsi:
děkuji, ono se v různých údajích udává i rozpětí, že vzroste 1,5 až 3 krát. Mně přijde, že pro hrubý odhad, že 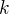 nezůstane stejné, je vyhovující.
nezůstane stejné, je vyhovující.
Je to tak? Děkuji a zdravím.
Offline

