Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 31. 01. 2012 20:42
celkový tlak v soustavě
Opět zdravím a doufám, že mi zase výpočty půjdou lépe :)
nevím si moc rady s tímto příkladem.
Při experimentu klesl parciální tlak N2O5 o 34,0 mmHg za 1 minutu v důsledku reakce v plynné fázi:
Jak se změnil celkový tlak v soustavě za uvedenou dobu?
Rovnici jsem si vyčíslila:
použila jsem vzorec:
p(B)= x(B) * p (kde x= n(B)/n(směsi))
p = p(B)/ x (B)
p= 34 / (2/5)
p= 85 mmHg
ale nevím, jak zjistím tu změnu celkového tlaku
děkuji
Offline
#3 01. 02. 2012 21:55
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: celkový tlak v soustavě
Opět pozdrav,
šla bych na to tak, že pokles parciálního tlaku N2O5 je v důsledku spotřeby jistého látkového množství n_N2O5 v reakci.
Dle reakce z 2 mol N2O5 vzniká 4 mol NO2 a 1 mol O2, potom z 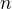 mol N2O5 vzniká
mol N2O5 vzniká 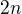 mol NO2 a
mol NO2 a 
 mol O2.
mol O2.
Pokles parciálního tlaku vstupního reagentu  , odsud vyjádřím
, odsud vyjádřím 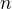 a dosadím do "stejných vzorců" pro parciální tlaky jednotlivých produktů. Jednotky nemusím převádět, jelikož i převod bude "přímo úměrný".
a dosadím do "stejných vzorců" pro parciální tlaky jednotlivých produktů. Jednotky nemusím převádět, jelikož i převod bude "přímo úměrný".
Souhlasí to s Tvým výpočtem (moc jsem ho nerozluštila)? Děkuji.
Offline
