Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 19. 02. 2012 11:54
elektrochemický ekvivalent
Dobrý den, chtěla bych se zeptat na jednu část z příkladu, který zní: Určete elektrochemický ekvivalent niklu v roztoku síranu nikelnatého  . Relativní atomová hmotnst niklu je 58,71. Jakou roli tedy zde má ta relativní atomová hmotnost?
. Relativní atomová hmotnst niklu je 58,71. Jakou roli tedy zde má ta relativní atomová hmotnost?
Offline
- (téma jako vyřešené označil(a) domin.a)
#2 19. 02. 2012 13:19 — Editoval Nautilux (19. 02. 2012 13:21)
Re: elektrochemický ekvivalent
No tak ta má zasádní roli, jelikož se používá k výpočtu Elektrochemického ekvivalentu látky.
Ten vypočteme tak, že molární hmotnost látky vydělíme Faradayovou konstantou a počtem elektronů potřebných k vyloučení jedné molekuly. 
║▌│█│║▌║││█C║h▌a│o║S▌║█║▌│█│║▌║
S∞=0100101001001010010100100101001001…
... 1 0 1 1 0 1 0 1 1 0 1 1 0 1 0 1 1 0 1 ...
█║▌│█│║▌║││█║▌│║▌║█║▌│█│║▌║││█║▌│║
Offline
#3 19. 02. 2012 16:12 — Editoval domin.a (19. 02. 2012 16:14)
Re: elektrochemický ekvivalent
↑ Nautilux:
a jak zjistíme počet elektronů? a molární hmotnost je stejná jako relativní atomová hmotnost?
Offline
#4 19. 02. 2012 17:25 — Editoval Nautilux (19. 02. 2012 17:26)
Re: elektrochemický ekvivalent
↑ domin.a:
Molární hmotnost:
"Molární hmotnost je fyzikální veličina, která udává hmotnost jednotkového látkového množství dané látky (tedy hmotnost 1 molu)." Jednotka je: kilogram na mol.
Relativní atomová hmotnost:
"Relativní atomová hmotnost (též poměrná atomová hmotnost) je podíl klidové hmotnosti atomu a atomové hmotnostní konstanty. Pro jeden atom přibližně odpovídá počtu nukleonů v jádře. U prvků v přírodě je dána poměrným zastoupením izotopů prvku." Jednotka je: bezrozměrná veličina.
V tom vzorci, máš jedinou neznámou a to je "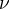 " to je oxidační číslo a to jak určitě víš definuje součet pozitivních a negativních nábojů v atomu. Nepřímo udává počet přijatých, nebo odevzdaných elektronů. Proto je tam číslo "2" jelikož máš roztok "síranu nikelnatého" což je: +II -natý.
" to je oxidační číslo a to jak určitě víš definuje součet pozitivních a negativních nábojů v atomu. Nepřímo udává počet přijatých, nebo odevzdaných elektronů. Proto je tam číslo "2" jelikož máš roztok "síranu nikelnatého" což je: +II -natý.
" " je Faradayova konstanta a ta vyjadřuje poměr mezi molární hmotností a elektrochemickým ekvivalentem látky, nebo též je to celkový elektrický náboj 1 molu látky úplně disociované nebo ionizované na částice s elementárním nábojem:
" je Faradayova konstanta a ta vyjadřuje poměr mezi molární hmotností a elektrochemickým ekvivalentem látky, nebo též je to celkový elektrický náboj 1 molu látky úplně disociované nebo ionizované na částice s elementárním nábojem:
kde:  je Avogadrova konstanta a
je Avogadrova konstanta a  je elementární náboj.
je elementární náboj.
║▌│█│║▌║││█C║h▌a│o║S▌║█║▌│█│║▌║
S∞=0100101001001010010100100101001001…
... 1 0 1 1 0 1 0 1 1 0 1 1 0 1 0 1 1 0 1 ...
█║▌│█│║▌║││█║▌│║▌║█║▌│█│║▌║││█║▌│║
Offline
