Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 11. 06. 2012 13:35
Chemická rovnováha
Zdravím vás,
potřebovala bych odůvodnit výsledky příkladu, doufám, že si na mě udělá někdo trochu čas :)
Chemická rovnováha reakce 2 SO2 (g) + O2 (g) -> 2 SO3 (g)
kdy 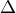 H = -190 kJ/mol, se posune na stranu produktu:
H = -190 kJ/mol, se posune na stranu produktu:
a) probubláváním směsi oxidem sírovým
b) snížením látkového množství kyslíku
c) snížením tlaku systému
D) CHLAZENÍM REAKČNÍ SMĚSI
E) ZVÝŠENÍM TLAKU V SYSTÉMU
f) zahříváním reakční směsi
Správné odpovědi jsou vyznačené.
Hned na začátku nerozumím tomu, co to znamená, když se chemická rovnováha posune na stranu produktu. Že toho produktu je více?
Dále nevím, jaký je rozdíl mezi směsí a systémem. Systém je reaktant a směs produkt?
A ohledně těch správných odpovědí, mě napadá jen možnost přímých a nepřímých úměrností že vzorce
(p.V) / T = konst.
A pak mě ještě mate, proč udávájí to H, jako vnitřní teplo..? Když je to číslo záporné, tak ta reakce je exotermická?
Vím, že vypadám jako nechápavec :D ale tady nad tím příkladem jsem zaražená jak..
Moc vás prosím o pomoc.
Hanka
Offline
- (téma jako vyřešené označil(a) hanasto)
#2 11. 06. 2012 15:13
Re: Chemická rovnováha
Žádná reakce neprobíhá tak, že by z veškerých reaktantů vznikly produkty. Reakce neustále probíhá na obě dvě strany, ovšem s rozdílnou rychlostí. Reakci zleva doprava se říká dopředná a zprava doleva se říká zpětná. Rychlost chemické reakce v obou směrach závisí na koncentraci výchozích látek. Čím víc je výchozích látek, tím je větší rychlost takové reakce. Když chemickou reakci necháme chvíli běžet, ustaví se takzvaná chemická rovnováha, která se vyznačuje tím, že rychlost reakce v obou směrech je stejná, takže koncentrace výchozích látek a produktů se již nemění. Když je více produktů, říkáme, že je rovnováha posunuta k produktům nebo také doprava, naopak při přebytku výchozích látek je rovnováha posunuta doleva. Tuto chemickou rovnováhu můžeme ovlivňovat různými vnějšími vlivy. Když například přisypeme do směsi výchozí látku, zrychlíme tím dopřednou reakci a reakce zase chvíli poběží doprava než se ustaví rovnováha. Naopak přidáme-li do směsi trochu produktu, tak posuneme rovnováhu doleva. Stejných změn můžeme dosáhnout měněním jiných vlivů. Například zvýšením teploty posuneme reakci v endotermickém směru, snížením teploty v exotermickém (neplést s aktivační energií). Podobně když zvýšíme tlak, tak posuneme reakci tam, kde mají produkty menší objem (poznáme to většinou tak, že je tam menší látkové množství plynů). Říká se tomu Le Chatelierův princip, viz http://cs.wikipedia.org/wiki/Le_Chatelierův_princip
ΔH je reakční enthalpie, tedy množství přijatého tepla za konstantního tlaku. Když je reakční enthalpie záporná, je reakce exotermická.
Offline

