Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#10 02. 10. 2012 22:43
Re: Výpočty pH
Aproximativně ano. Nejde ovšem o koncentrace, ale o to, že na jednu molekulu nerozloženého NaOH připadají asi tři rozložené. Viz odkaz (pardon za absenci tagu - mobil) jergym.hiedu.cz/~canovm/ph/ph2/rovnovah.htm
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#12 02. 10. 2012 23:10
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočty pH
↑ houbar:
no ano, ale školní úlohy tohoto typu (pH silné zásady) jsou pro takové koncentrace, kde je výsledek ze základního vzorce. Pokud jinak, tak to bývá upřesněno. Nevím teď, jaký je efekt takové debaty ve vztahu k úvodnímu příspěvku?
Necháme, prosím, na lepší časy. Představa, že se něco píše z mobilu, je pro mne nepředstavitelná (a po půldne výuk na jazykovce je pro mne nepředstavitelné skoro všechno) . Pohodový večer.
Offline

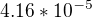 . pOH je poté záporný logaritmus z
. pOH je poté záporný logaritmus z  . Tudíž je potom pOH rovno 4.38 a pH vypočítám jako 14 - pOH. Výsledek má ale být 12.62.
. Tudíž je potom pOH rovno 4.38 a pH vypočítám jako 14 - pOH. Výsledek má ale být 12.62.  je mol/litr (mně to vyšlo dobře). V pořádku? Děkuji.
je mol/litr (mně to vyšlo dobře). V pořádku? Děkuji.
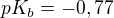 ...
...