Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
Stránky: 1
- Hlavní strana
- » Chemie
- » Reakce obecných a vzácných kovů kyselinami (TOTO TÉMA JE VYŘEŠENÉ)
#1 29. 12. 2013 13:32
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Reakce obecných a vzácných kovů kyselinami
Dobrý den,
potřeboval bych velkou pomoc ohledně jednoho tématu. Začali jsem brát jednu látku, kde máme napsat reakci rovnice a zároven ji vyčíslit. Reakci máme provést na základě poznatku, zda-li se v rovnici vyskytuje obecný kov, či vzácný (ušlechtilý) kov a také, zdali reaguje s kyslíkatými či s bezyslíkatými kyselinami. Problém je v tom, že s námi profesorka žádnou rovnici nedělala, ale dala je nám do testu. Jediné co nám řekla je to, co s čim a jak reaguje - a to si ani stále nejsem jistý, pokud je to správně.
Zde je zadání:
V sešitě mám zapsáno toto:
Vzácné kovy
-Nereagují s bezkyslíkatými, kromě mědi
-S kyslíkatými kyselinami reagují stejně jako obecné, vzniká sůl kyseliny, vodní pára, těkavý oxid (dusnatý -> dusičnatý)
-S kyslíkatými kyselinami nikdy nedávají vodík, ale sůl
Obecné kovy
Reagují s bezkyslíkatými kyselinami i s kyslíkatými stejně, tedy vznikne sůl dané kyseliny a vodík
Co bych potřeboval vědět je:
-Seznam obecných kovů (všechny)
-Seznam vzácných kovů (všechny)
-Co je ag. (co to dělá)
-Jaký vliv má koncentrovaná kyselina v rovnici na její reakci
-Ujistit se, zda-li mé poznatky z hodiny zapsané v sešitě odpovídají realitě
-Pokud možno, tak ukázat všechny odlišné situace, které mohou nastat v rovnicích z cvičení (jak to bude vypadat)
-Vědět, zdali je nějaký jiný nebo jednodušší postup, jak zjistit reakci těchto rovnic
Jde mi o to, abych to pochopil (ne to mít vyřešený, v žádném případě). Pokud budu vidět náznaky chemického záblesku, pokusil bych se na základě vaší pomoci vyřešit nějaké rovnice z tohoto zadání + bych pak ještě nějaký jsem dodal, abych se ujistil, že to už konečně chápu.
P.S. Snažil jsem se nějakým způsobem docílit toho, že se látku naučim prostřednictvím materiálu publikovaných na internetu, ale nic užitečného pro sebe jsem nenašel. Proto se chci pokusit to dozvědět tady.
Budu rád za každou pomoc, díky!
Offline
- (téma jako vyřešené označil(a) Vladislav97)
#2 30. 12. 2013 18:39
Re: Reakce obecných a vzácných kovů kyselinami
„Seznam“ ušlechtilých (obecných) a neušlechtilých kovů najdeš v elektrochemické řadě kovů.
Její redukovaná verze je např. na Wikipedii:
http://cs.wikipedia.org/wiki/Beketovova … _kov%C5%AF
Kompletnější např. tady:
http://canov.jergym.cz/elektro/beketov/potence.html
Kovy, které mají záporné rozpouštěcí napětí (či elektrodový potenciál) jsou kovy obecné a ty, které ho mají kladné jsou ušlechtilé.
(V řadě jsou obecné nalevo od vodíku, ušlechtilé napravo, vodík byl do řady zařazen pro svůj nulový potenciál... = tvoří mezník)
Ag tu má pravděpodobně značit, že jde o vodný roztok kyseliny sírové... (standardně se pro to používá zkratka aq
jako aqua..., tak je to buď nějaký jiný systém značení... (nebo překlep?...))
Jinak v tomhle případě ta reakce stejně neproběhne (Au nereaguje s kyselinou sírovou...)
Koncentrace kyseliny má vliv např. na rychlost reakce. Nebo způsobuje vznik rozdílných oxidů (při reakci mědi a kyseliny dusičné koncentrované vznikne oxid dusičitý, při reakci se zředěnou vznikne oxid dusnatý...)
Často také ovlivňuje, jestli reakce proběhne, nebo ne... třeba:
pokud je kyselina sírová koncentrovaná, pak železo pasivuje a dále nereaguje, je-li ale zředěná vzniká síran železnatý a vodík... (to je, spolu se snahou uspořit místo, důvod, proč se přepravuje koncentrovaná...)
Ohledně tvých poznatků..., myslím, že měď není žádná výjimka mezi ušlechtilými kovy a s bezkyslíkatými nereaguje (např. reakce Cu + HCl neproběhne...)
Jinak ti doporučuju přečíst článek na Wikipedii..., je to tam celkem pěkně vysvětleno... Největším problémem tohoto typu reakcí je nutnost znát, alespoň matně, elektrochemickou řadu kovů... :)
Offline
#3 31. 12. 2013 14:55
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
Pokusím se o svoje řešení. Byl bych rád, kdyby by mi to někdo zkontroloval a pokud by bylo něco špatně, tak pokud možno se zdůvodněním, proč by to mělo být jinak.
Zadání:
A) -> Al2SO4 + H2
B) -> Fe(NO3) + Na
C) -> Li (OH) + H2
D) -> Cu(NO3) + H2O + NO2
E) -> ZnCl2 + H2
F) -> Mg(SO4) + H2
G) Neraguje
H) -> Hg(NO3) + H2O + NO2
I) -> Nereaguje
J) -> Ca(OH) + H2
Offline
#5 01. 01. 2014 12:15
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
↑ houbar:
Zdravím,
mohl bych se zeptat v jakých případech? Orientuju se v tom opravdu jen matně. + se také chci zeptat, zdali pak bude vyčíslená i levá strana rovnice v některých případech. Díky : ).
Offline
#6 01. 01. 2014 12:23
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Zdravím,
celé jsem neprocházela, ale pravá strana rovnic v ↑ příspěvku 3: není k zadání na scanu. Ale v každém případě vzorce sloučenin třeba překontrolovat a každá reakce se vyčísluje jako celek ve všech případech.
zdali pak bude vyčíslená i levá strana rovnice v některých případech.
Offline
#7 01. 01. 2014 13:42 — Editoval Vladislav97 (01. 01. 2014 13:44)
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
↑ jelena:
Pravda, omlouvám se.
Nové zadání:
Zajímavé je, že u většiny se mi nedařilo vyčíslovat podle oxidace a redukce, ale jen logicky...(na to se kouknu pak).
Offline
#8 01. 01. 2014 16:43
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
děkuji, pěkné, ale celkem och :-) Buď jsi nedával pozor při sestavení vzorců produktů, nebo pozapomněl, ale viz komentář kolegy ↑ houbar: ohledně mocenství. Opravíš si to sám (stačí dodržovat možné oxidační číslo ve sloučenině dle pravidel periodické tabulky)?
Reakce B, H nejsou dobře již z principu tématu, ještě se podívej na řadu kovu. U ostatních je spíš problém s tvorbou vzorce produktu, pokud jsem nic jiného nepřehlédla.
Offline
#9 01. 01. 2014 18:28 — Editoval studentka94 (01. 01. 2014 18:41)
- studentka94

- Příspěvky: 73
- Škola: Ostrava
- Pozice: student
- Reputace: 7
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Trošku poupravím .. .. vzniká síran hlinitý + vodík + správně vyčíslit ..
.. vzniká síran hlinitý + vodík + správně vyčíslit .. .. protože železo je od sodíku více v pravo v beketově řadě kovů ..
.. protože železo je od sodíku více v pravo v beketově řadě kovů .. .. bez závorek ..
.. bez závorek .. .. s koncentrovanou vzniká vzniká dusičnan meďnatý + oxid dusičitý + voda + správně vyčíslit ..
.. s koncentrovanou vzniká vzniká dusičnan meďnatý + oxid dusičitý + voda + správně vyčíslit .. .. vzniká chlorid zinečnatý + vodík + správně vyčíslit ..
.. vzniká chlorid zinečnatý + vodík + správně vyčíslit .. .. vzniká síran hořečnatý + vodík ..
.. vzniká síran hořečnatý + vodík ..
 .. se zředěnou kyselinou dusičnou vzniká dimér dusičnanu rtuťného + správně vyčíslit ...
.. se zředěnou kyselinou dusičnou vzniká dimér dusičnanu rtuťného + správně vyčíslit ... .. protože měď je od železa více vpravo ..
.. protože měď je od železa více vpravo .. .. vzniká hydroxid vápenatý
.. vzniká hydroxid vápenatý
Offline
#10 01. 01. 2014 18:40
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
↑ jelena:
Děkuji, asi jediné mi chybí pochopit, jaké oxidační číslo doplnit, pokud jich je u toho prvku více. :)
↑ studentka94:
Děkuji moc! Hned se na to kouknu.
Offline
#11 01. 01. 2014 19:08 — Editoval Vladislav97 (01. 01. 2014 19:08)
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
Takže nezáleží pouze na tom, zda-li je to kov obecný, ale také, pokud je to "víc vpravo, či víc vlevo"?
1)Změní se nějak reakce, pokud nebude koncentrovaná? Nebo to je vždy takhle?
2) Měd reaguje pouze s kyselinou dusičnou?
Takže toto vyčíslení by neplatilo i přesto, že je to na obou stranách vyrovnané
Opravdu je to správně? Já jsem tam přeřizoval ještě tu dvojku.
Já t měl takto:
Tomu vůbec nerozumim :-D. Tady, pokud chápu, tak ani není těkavý oxid. Takže reakce vypadá vždy jinak, pokud se jedná o zředěnou kyselinu? Jelikož kdyby tu byl těkavý oxid, tak je tam, ne?
Já myslel, že mě nezajímá to železo, ale zdali je to síran, či Dusičnan. takže prvky, více vlevo by reagovali s Mědí?
Takže také by to nešlo nechat takhle? Nebo správně je opravdu:
Díky!
Offline
#12 01. 01. 2014 19:45
- studentka94

- Příspěvky: 73
- Škola: Ostrava
- Pozice: student
- Reputace: 7
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Nejprve se pořádně naučit anorganické názvosloví :)
B) Důležité je umět Beketovu řadu kovů: prvek, který se nachází více vlevo, je schopný vytěsňovat .. železo je bohužel vpravo od sodíku, proto není schopný ho vytěsnit. Kdyby železo bylo vlevo od sodíku, tak by ho vytěsnilo, ale bohužel to tak není.
D) Je rozdíl, jestli měď reaguje se zředěnou nebo s koncentrovanou kyselinou dusičnou.
KONCENTROVANÁ
ZŘEDĚNÁ
MŮŽE REAGOVAT S KYSELINOU SÍROVOU ..
E) MUSÍŠ RESPEKTOVAT PRAVIDLA NÁZVOSLOVÍ!
Zinek je pouze v oxidačním čísle II .. křížové pravidlo a je pouze správně .. 
F) OPĚT MUSÍŠ RESPEKTOVAT PRAVIDLA NÁZVOSLOVÍ!
Je to sůl kyseliny sírové .. 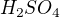 .. po odrtžení vodíků získám ..
.. po odrtžení vodíků získám .. 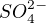
HOŘČÍK je pouze v oxidačním čísle II .. křížové pravidlo a je pouze správně .. 
H) Opět je rodíl mezi koncentrovanou a zředěnou ..
ZŘEDĚNÁ 
Rtuť může mít oxidační číslo II, i oxidační číslo I, ale sloučeniny s oxidačním čísle I tvoří ve sloučeninách diméry, které jsou charakteristické vazbou kov-kov .. př. dimér dusičnanu rtuťného  , který vzniká u této reakce případně dimér chloridu rtuťného zvaný kalomel ..
, který vzniká u této reakce případně dimér chloridu rtuťného zvaný kalomel .. 
KONCENTROVANÁ .. tady nám vznikl dusičnan rtuťnatý, kde se rtuť nachází v oxidačním čísle II ..
.. tady nám vznikl dusičnan rtuťnatý, kde se rtuť nachází v oxidačním čísle II ..
I) Prvky, které se nacházejí více vlevo od železa, jsou schopné ho vytěsnit .. opět platí Beketova řada kovů ..
J) OPĚT RESPEKTUJ PRAVIDLA ANORGANICKÉHO NÁZVOSLOVÍ!
Ca je pouze v oxidačním čísle II .. křížové pravidlo a je pouze správně 
 .. JSOU NESMYSL!! .. jiné by bylo například ..
.. JSOU NESMYSL!! .. jiné by bylo například ..  .. řídit se oxidačními čísly! Takže procvičuj chemické názvosloví! :-) ..
.. řídit se oxidačními čísly! Takže procvičuj chemické názvosloví! :-) ..
Offline
#13 01. 01. 2014 20:50
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
↑ studentka94:
Díky moc! :)
Nějakým způsobem jsem si to dál dohromady. Ted se zeptám ale další věc.
Dejme tomu, že máme obecný kov, který reaguje s kyselinou, či solí (přičemž kationt sole je prvek, který je umístněný více napravo od obecného kovu). Nebo také, když ušlechtilý kov reaguje se solí, přičemž kation sole je prvek, který se nachází opět více na pravo.V tomto případě teda nezáleží na tom, zda-li kyselina či sůl je ředěná, nebo koncentrovaná a mohu postupovat jako kdyby tam nic nebylo? Graficky:
Třeba
Zn Cr Nb Ga Fe Cd In Tl Co Ni Sn Pb W H Mo Tc Re Bi Cu Os Rh 
(A- Kationt soli, který nese vzácný kov více na pravo B- Aniont)
Třeba
Zn Cr Nb Ga Fe Cd In Tl Co Ni Sn Pb W H Mo Tc Re Bi Cu Os Rh
Např.
Je sice ředěna. Ale postupuje se normálně, jako kdyby tam nic nebylo. V podstatěje to samý jako
.
Např.
Je sice ředěná, ale zinek je napravo od vodíku, a proto postupuju normálně.
Např.
Je sice koncentrovaná, ale opět, Hořčík je napravo od vodíku, tedy to můžu zanedbat a tim pádemje totéž jako
.
---------------------------------------------------------------------------------------------------------------------
Na druhou stranu. Dejme tomu, že máme obecný kov, který reaguje s kyselinou, či solí (přičemž kationt sole je prvek, který je umístněný více nalevo od obecného kovu). Nebo také, když ušlechtilý kov reaguje se solí, přičemž kation sole je prvek, který se nachází opět více nalevo. V tom případě pak postupuji, jaksi popsala?
Aq - Diméy
Konc. - Těkavý oxid
Třeba
Zn Cr Nb Ga Fe Cd In Tl Co Ni Sn Pb W H Mo Tc Re Bi Cu Os Rh 
(A- Kationt soli, který nese vzácný kov více nalevo, nebo to je vodík, nebo jakýkoliv obecný kov B- Aniont)
Třeba
Zn Cr Nb Ga Fe Cd In Tl Co Ni Sn Pb W H Mo Tc Re Bi Cu Os Rh
Např.
Rtut je více napravo od vodíku.
Offline
#14 01. 01. 2014 22:16 — Editoval studentka94 (02. 01. 2014 03:44)
- studentka94

- Příspěvky: 73
- Škola: Ostrava
- Pozice: student
- Reputace: 7
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Jsem bohužel nemocná, takže moc nechytám tvůj text, máš ho zmatený a navíc špatně rozlišuješ levou a pravou stranu. a
a 
Místo obecného a vzácného kovu (neříkám, že je to špatně) používej raději pojmy neušlechtilé kovy a ušlechtilé kovy.
Jinak co se týče těch reakcí, tak bohužel vždy neplatí uvedená pravidla, proto je třeba se vzniklé produkty naučit nazpaměť .. ÚPLNĚ BY NEJLEPŠÍ BYLO, NEŽ SE TO UČIT OBECNĚ, POSTUPNĚ SE UČIT JEDNOTLIVÉ PRVKY (vlastnosti, sloučeniny, výroby, přípravy) a PAK TI VŠECHNY ROVNICE NASKÁČOU DO HLAVY ..
Uvádím stručnou Beketovu řadu kovů ..
NEUŠLECHTILÉ kovy (kovy vlevo od vodíku) reagují s bezkyslíkatými i kyslíkatými kyselinami!
A protože jsou nalevo od vodíků, tak jsou schopné ho vytěsnit za vzniku soli a vodíku.

a tak dále ...
Vyjímkou může být třeba olovo či cín, které utíkají výše uvedenému pravidlu, ono to jsou neušlechtilé kovy nalevo od vodíku, přesto reagují trochu odlišně ..
Například ..




Zrada může třeba být u zinku Zn (také je to neušlechtilý kov vlevo od vodíku) .. .. známá reakce přípravy vodíku :)
.. známá reakce přípravy vodíku :)
Pokud však použijeme koncentrovanou kyselinu sírovou 96%, tak je kyselina zinkem redukována ..
SOLI
Tam je se třeba řidít pravidlem .. .. reakce proběhne .. podíváme se na železo, kde se v Beketově řadě kovů nachází vůči mědi a protože železo je nalevo od mědi, tak ho vytěsní ..
.. reakce proběhne .. podíváme se na železo, kde se v Beketově řadě kovů nachází vůči mědi a protože železo je nalevo od mědi, tak ho vytěsní .. .. podíváme se na meď, kde se v Beketově řadě kovů nachází vůči železu, a protože měď se nachází napravo od železa, reakce neproběhne ..
.. podíváme se na meď, kde se v Beketově řadě kovů nachází vůči železu, a protože měď se nachází napravo od železa, reakce neproběhne ..
UŠLECHTILÉ KOVY napravo od vodíku reagují pouze s kyslíkatými kyselinami ..
DIMÉRY se ZŘEDĚNOU KYSELINOU dusičnou vznikají pouze u rtuti!
U rtuti se třeba odlišuje koncentrovaná x zředěná ..

U stříbra ..
S kyselinou dusičnou vzniká .. 

S kyselinou sírovou .. 
Zlato reaguje pouze v lučavce královské ..
Všechny reakce mědi
http://canov.jergym.cz/anorgrov/rovnice/cu.html#prvek
Všechny reakce stříbra
http://canov.jergym.cz/anorgrov/rovnice/ag.html
Všechny reakce zlata
http://canov.jergym.cz/anorgrov/rovnice/au.html
Všechny reakce rtuti
http://canov.jergym.cz/anorgrov/rovnice/hg.html#prvek
Pokud budeš chtít další prvky, tak třeba když rozklikneš reakce mědi, tak dole je tabulka, vybereš si jakýkoli prvek a zobrazí se ti reakce se všemi sloučeninami/kyselinami a tak dále ..
Ale jak říkám, NEJLEPŠÍ BY BYLO PROJÍT A POSTUPNĚ SE NAUČIT JEDNOTLIVÉ PRVKY, A PAK SE TI JEDNOTLIVÉ VĚCI PROPOJÍ A BUDEŠ VŠEMU ROZUMNĚT!
Offline
#15 01. 01. 2014 22:47
Re: Reakce obecných a vzácných kovů kyselinami
↑ studentka94:
Jste si jistá těmi dimery u rtuti? Mně to přijde divné, vždyť kyselina dusičná je oxidant jaxviňa. Nezoxiduje to posléze ten dimer na rtuťnatou sůl?
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#16 02. 01. 2014 01:15 — Editoval studentka94 (02. 01. 2014 03:35)
- studentka94

- Příspěvky: 73
- Škola: Ostrava
- Pozice: student
- Reputace: 7
Re: Reakce obecných a vzácných kovů kyselinami
↑ houbar:
Obecně RTUŤNÉ  jsou dimerní, spojené kovaletní vazbou a snadno se časem oxidují na rtuťnaté soli, ale u dusičnanu rtuťnatého to tak úplně jednoduché není. Časem může se sám oxidovat na rtuťnaté, ale v reakcích se zředěnou kyselinou se zachovává v podobě diméru dusičnanu rtuťnatého. Pokud použijeme koncentrovanou, tak automaticky vznikne rtuťnatá sůl. Časem určitě se pan Vladislav97 k tomu studiem ve škole či doma dostane, ale myslím si, že to pro něj teď podstatné není - hlavní je, aby si zapamatoval reakci a věděl, že u rtuti existují diméry. Hlavně, ať pochopí základní principy a doučí se pořádně názvosloví.
jsou dimerní, spojené kovaletní vazbou a snadno se časem oxidují na rtuťnaté soli, ale u dusičnanu rtuťnatého to tak úplně jednoduché není. Časem může se sám oxidovat na rtuťnaté, ale v reakcích se zředěnou kyselinou se zachovává v podobě diméru dusičnanu rtuťnatého. Pokud použijeme koncentrovanou, tak automaticky vznikne rtuťnatá sůl. Časem určitě se pan Vladislav97 k tomu studiem ve škole či doma dostane, ale myslím si, že to pro něj teď podstatné není - hlavní je, aby si zapamatoval reakci a věděl, že u rtuti existují diméry. Hlavně, ať pochopí základní principy a doučí se pořádně názvosloví.
Příkládám pár materiálů :-)


Offline
#17 02. 01. 2014 10:15
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
Zdravím v tématu a děkuji za podrobnou diskusi.
Trošku škoda, že kolegyňka ↑ studentka94: nenechala prostor kolegovi Vladislavovi pro samostatné bádaní (z předchozích jeho témat vidět, že je vytrvalý, pečlivý a samostatný :-))
Řekla bych, že dostali zatím spíš trochu zjednodušený pohled na celou problematiku (ale pro první orientaci a pochopení dostačující), proto bych uvažovala spíš tvrdší podmínky reakce. Případně si vybavit, zda značkou (aq) paní učitelka označuje ředěnou kyselinu oproti (konc.), kterou značí koncentrovanou. Skoro bych tak viděla. Jemné podrobnější upřesnění určitě používat může a učitelku to jedině potěší. Ale nejdřív pochopit zásadní podstatu.
Ohledně reakce Hg - ano, uvádí se ve více možných dle ředění kyseliny (i u jiných kovů to vidíme).
studentka94 napsal(a):
a doučí se pořádně názvosloví.
:-) všimla jsem, že v tom smyslu opakuješ. Ovšem názvosloví je až odrazem správného sestavení vzorce z podstaty vlastností prvků, sloučenin a probíhajících reakcí.
A drobná Moderátorská: velké písmo v internetových diskusích je považováno za zvyšování hlasu, tak to, prosím, zvýrazňuj jinak. Děkuji.
A žádná nemoc, ale pořádné zdraví do nového roku a nejen.
Offline
#18 02. 01. 2014 11:23
Re: Reakce obecných a vzácných kovů kyselinami
↑ studentka94:
Já zas tak blbej nejsem. Mohu poprosit, odkud jsou ty materiály? Já jsem si v učebnici páně Wilkinsona našel, že se rtuťné soli tvoří těžko pomocí běžného oxidačního činidla. Že to jde jen když je rtuť v mol. poměru vůči oxidantu tak, že jí je 2x víc. Tak jsem si myslel, že by HNO3 mohla být běžným oxidačním činidlem.
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#20 02. 01. 2014 16:10 — Editoval jelena (02. 01. 2014 20:06)
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
↑ houbar:
to je ve formátu djvu (zkus si přidat vhodný prohlížeč). V pdf je tady (v bídné kvalitě a s překlepem v reakci). Doma se podívám, zda je něco v Remy (nebo i do některé jiné knížky).
Edit: podíváno, je v Remy a v jiných (ruských starých) knížkách, novější nemám. V přehledu středoškolské chemie je jen náznak o Hg_2(2+). Já bych pořád tuto reakci řadila do složitější varianty (už třeba z pohledu vyčíslení). Pokud vyloženě paní učitelka neuvedla jako příklad, tak bych vypsala variantu s koncentrovanou kyselinou.
Offline
#21 03. 01. 2014 12:35 — Editoval Vladislav97 (03. 01. 2014 12:56)
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
↑ jelena:
Děkuji : ). Je bohužel škoda, že nám to paní učitelka není schopná vysvětlit a musim k tomu hledat jinou cestu, jak docílit chápaní tohoto tématu.
↑ studentka94:
Děkuji moc za velkou snahu a podrobnou pomoc v tomto tématu!
↑ runcorne:
Také děkuji za pěkné úvodní vysvětlivky! :)
↑ houbar:
Děkuji za zapojení do diskuze :).
Obecně se dá se říci, že jsem toto téma začal chápat více. Na druhou stranu, stále mám v něčem zmatek. Ale ten můj okamžik přijde! :)
Pokud možno, označil bych toto téma jako Vyřešené a zdal bych nové téma, kde bych dořešil ten první scan v tomto tématu. To by pouze obsahovalo zadání a moje řešení (tentokrát doufám, že jsem se trochu poučil).
Díky všem!
Offline
#22 03. 01. 2014 13:29
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Zdravím a děkuji za děkuji (i všem účastníkům tématu),
paní učitelka to nemá jednoduché - vysvětlit podrobně je opravdu obtížné a není k tomu dostatečná báze, ani časový prostor. V podstatě musíš pochopit základní kostru: řadu elektronegativity a rozdělení kovů + rozdíl v působení kyselin "oxidujících" a "neoxidujících". Je to velmi orientační, ale pravděpodobně odpovídá tomu, co si představuje i paní učitelka. Hodně zdaru.
Offline
#23 06. 01. 2014 21:28
- Vladislav97

- Místo: Praha
- Příspěvky: 421
- Škola: Gymnázium
- Pozice: Student (Druhák)
- Reputace: 13
Re: Reakce obecných a vzácných kovů kyselinami
Dne jsem se dozvěděl, že podle paní profesorky reakce  , lépe
, lépe  by neměla vůbec reagovat, protože prý vzácný kov s zředěnýma kyselinama nereaguje. Hm.
by neměla vůbec reagovat, protože prý vzácný kov s zředěnýma kyselinama nereaguje. Hm.
Offline
#24 10. 01. 2014 01:03
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakce obecných a vzácných kovů kyselinami
↑ Vladislav97:
Zdravím a děkuji za upřesnění. Vypadá to, že paní učitelka trošku "zjednodušila a schematizovala" situaci, ale celkem rozumím - viz "schéma" ↑ příspěvku 22: + rozlišuje kyselinu konc. a aq (ředěnou) - pro pochopení principu to přehledné je. Podrobnější výklady a informace, co jsou v tématu ale určitě na škodu nebudou.
Offline
Stránky: 1
- Hlavní strana
- » Chemie
- » Reakce obecných a vzácných kovů kyselinami (TOTO TÉMA JE VYŘEŠENÉ)















