Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 16. 05. 2014 12:28 — Editoval jelena (16. 05. 2014 15:16)
- Snupinka22

- Příspěvky: 39
- Škola: Pedf UK
- Pozice: student
- Reputace: 0
Výpočet pH a stupně disociace
Mohl byste mi prosím někdo pomoci s tímto příkladem?
Vypočítejte pH vodného roztoku kyseliny chloroctové (pKA= 2,87) o koncentraci 1,0‧10-3mol dm-3 a stupeň disociace kyseliny chloroctové v tomto roztoku.
Vycházím z tohoto vzorečku - ![kopírovat do textarea $pH=\frac{1}{2}[p_{K_a}-\log(C_{m})_{r}]$](/mathtex/7f/7fee1e70fe1552caeaf27c5cd23c7551.gif) Nejsem si jistá, zda za koncentraci dosadit 1 nebo koncentraci ze zadání...
Nejsem si jistá, zda za koncentraci dosadit 1 nebo koncentraci ze zadání...
pro výpočet disociační konstanty používám tento vzoreček - 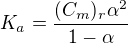
Výsledku se ale nemohu dobrat...
Offline
#2 16. 05. 2014 15:17
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
Zdravím,
opravila jsem zápis v TeX, řekla bych, že vzorce jsou v pořádku, dosazovat koncentraci, kterou máš v úloze. Napiš, prosím, celý výpočet a případně i výsledek (může být překlep ve výsledku).
Offline
#3 16. 05. 2014 21:28 — Editoval Snupinka22 (17. 05. 2014 09:46)
- Snupinka22

- Příspěvky: 39
- Škola: Pedf UK
- Pozice: student
- Reputace: 0
Re: Výpočet pH a stupně disociace
↑ jelena:
Postup dělám takový:

S výpočtem stpně disociace postupuji takto:




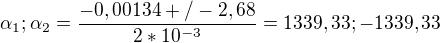
Výsledky jsou však naprosto mimo...
Offline
#4 17. 05. 2014 00:09
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ Snupinka22:
děkuji, pH mi vychází stejně, jako Tobě - výsledek.
Pokud je výsledek odsud, tak  už mám stejně (tedy nechala jsem počítat). Zkusím zeditovat Tvé zápisy, potom se podívám, zda v tom není chyba v úpravách. Zápisy v TeX je třeba dávat do "dolarů" (pod oknem zprávy je tlačítko).
už mám stejně (tedy nechala jsem počítat). Zkusím zeditovat Tvé zápisy, potom se podívám, zda v tom není chyba v úpravách. Zápisy v TeX je třeba dávat do "dolarů" (pod oknem zprávy je tlačítko).
Offline
#5 17. 05. 2014 00:24
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ Snupinka22:
řekla bych, že chyba při výpočtu diskriminantu, má být výsledek odmocniny z D jako v odkazu
to je zapsáno dobře, jen to ještě přepočti.
Offline
#7 17. 05. 2014 09:31
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ houbar:
Zdravím a děkuji, to mi moc nesedí, co navrhuješ (hlavně rozměrově?). Ale necháme to až budeš mít pohodlnější připojení (u sebe bych viděla už na závěr víkendu - jsou jiné plány).
Offline
#8 17. 05. 2014 14:40
Re: Výpočet pH a stupně disociace
↑ jelena:
Rozměrově je to v pořádku, do takovýchto konstant se dosazují bezrozměrná čísla. Kvadratickou rovnicí vychází pH 3,175.![kopírovat do textarea $K_A = \frac{\[A^-\] \cdot \[H^+\]}{\[HA\]} \nl
K_A = \frac{\[H^+\]^2}{\[HA\]} \nl
K_A = \frac{\[H^+\]^2}{c_{kys} - \[H^+\]}$](/mathtex/43/4367a4c81f5944ff8c42cd5a002e3a91.gif)
Tady je si třeba říct, že rovnovážná koncentrace toho aniontu bude jiná, než zadaná koncentrace roztoku kyseliny. Na začátku, ještě před ustavením rovnováhy, máme koncentraci kyseliny c. Po ustavení rovnováhy se nám koncentrace nerozdisociované kyseliny zmenší o stejně, o kolik se zvětší koncentrace aniontů, potažmo H+ iontů.
Platí tedy:![kopírovat do textarea $\[H^+\]^2 + \[H^+\] \cdot K_A - K_A \cdot c_{kys} = 0$](/mathtex/3c/3cf37bdc27f619f2e2bfe3b8348d538c.gif)
Vyjdou dvě řešení, jedno z nich je záporné, tudíž pro nás nemá smysl.![kopírovat do textarea $\[H^+\] \doteq 6,686 \cdot 10^{-4} \nl
pH \doteq 3,175$](/mathtex/88/88b157c6e17572a706a3bf6f565168e1.gif)
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#9 18. 05. 2014 16:14
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ houbar:
Zdravím,
Rozměrově je to v pořádku, do takovýchto konstant se dosazují bezrozměrná čísla
to asi těžko, dosazuji se látkové množství - tak? Ty uvažuješ přeměnu v 1 litru roztoku, kde je 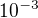 mol původní kyseliny, která prochází disociaci s disociačním stupněm
mol původní kyseliny, která prochází disociaci s disociačním stupněm  , tedy z každého 1 mol disociuje
, tedy z každého 1 mol disociuje  mol kyseliny a vzniká atd. Což je totéž jako smysl vzorce
mol kyseliny a vzniká atd. Což je totéž jako smysl vzorce 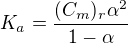 (můžeme to i vzájemně upravit). Souhlasíš?
(můžeme to i vzájemně upravit). Souhlasíš?
Co potom má být v úloze (co se nemá zanedbávat), aby se místo vzorce ![kopírovat do textarea $pH=\frac{1}{2}[p_{K_a}-\log(C_{m})_{r}]$](/mathtex/7f/7fee1e70fe1552caeaf27c5cd23c7551.gif) používal Tvůj postup. Pokud bys výsledek neviděl, použil bys automaticky vzorec? Děkuji.
používal Tvůj postup. Pokud bys výsledek neviděl, použil bys automaticky vzorec? Děkuji.
Offline
#10 18. 05. 2014 18:19
- Snupinka22

- Příspěvky: 39
- Škola: Pedf UK
- Pozice: student
- Reputace: 0
Re: Výpočet pH a stupně disociace
↑ jelena:
Oběma vám moc děkuji za rady, jen se v tom nějak začínám ztrácet.... Který vztah je tedy správný? Ten houbařův" Výsledek totiž vyšel tak, jak je uvedeno ve výsledcích...
Offline
#11 18. 05. 2014 18:59
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ Snupinka22:
no to také nevím (kolega je velmi zkušený, navíc zná i modernější pohledy na chemii) - ale jak mám ze zadání posoudit, že vzorec nejde použit? úloha 8 Tobě vyšla dobře (octová je slabší, než chloroctová - máte to někde zdůrazněno)? Je u vás i teoretický materiál k náhledu? Děkuji.
Offline
#13 18. 05. 2014 19:08
Re: Výpočet pH a stupně disociace
Jinak obecně se říká, že pokud není koncentrace kyseliny zhruba desetkrát větší jak Ka té kyseliny, tak se musí počítat "s tím mým vzorcem."
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#14 18. 05. 2014 19:16
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Výpočet pH a stupně disociace
↑ houbar:
děkuji, kolegovi Canovi věřím již dobrých 10 let (a Tobě :-), je to ve větě: Při zanedbání tohoto rozdílu, lze obě tyto koncentrace považovat za shodné (zde klik na řešení, kde se toto zjednodušení neprovádí). Potom to ↑ Snupinka22: musí někde mít.
Děkuji.
Offline
#15 19. 05. 2014 00:25
- Snupinka22

- Příspěvky: 39
- Škola: Pedf UK
- Pozice: student
- Reputace: 0
Re: Výpočet pH a stupně disociace
↑ houbar:
Děkuji moc, za tento vztah, v učebnici co mám k dispozici jsem ho nikde nenašla, ale hlavní je, že to vychází. Mohl bys mi prosím ještě poradit s tím stupněm disociace? Lze vypočítané pH nějak použít pro vpočet stupně disociace?
Offline


![kopírovat do textarea $K=\frac{\[H+\]^2}{c_{kys} - \[H+\]}$](/mathtex/3c/3ce62556aa23e47b60b57069727a2ac7.gif)