Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 31. 10. 2015 11:01
Reakční kinetika
Dobrý den,
moc bych chtěla poprosit o kontrolu a o pomoc s příklady. Jsou tři, dva z nich jsem nějak vypočítala, ale nevím jestli správně (nemám bohužel výsledky), ale s třetím si nevím moc rady.
1) V rovnovážné směsi mají plyny 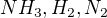 při teplotě
při teplotě  tyto koncentrace:
tyto koncentrace:


Vypočtěte rovnovážnou konstantu při éto teplotě.
2) Směs vodíku a jodových par byla zahřívána na  až do ustavení rovnováhy. Při této teplotě má reakce:
až do ustavení rovnováhy. Při této teplotě má reakce: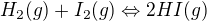
rovnovážnou konstantu 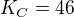 .
.
V rovnovážné směsi byly koncentrace: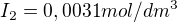
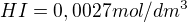
Vypočtěte rovnovážnou koncentraci 
3) Při výrobě kyseliny sírové se oxiduje oxid siřičitý podle rovnice: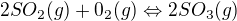
Při teplotě  byly v uzavřeném systému naměřeny tyto relativní (parciální) tlaky:
byly v uzavřeném systému naměřeny tyto relativní (parciální) tlaky:

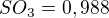
Jakou hodnotu má rovnovážná konstanta  (vyjádřená pomocí relativních tlaků) pro tuto reakci?
(vyjádřená pomocí relativních tlaků) pro tuto reakci?
_______________________________________________________________________
Moje pokusy
1) Využila jsem Guldberg-Waagův zákon a sestavila rovnici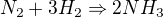
K mi vyšlo 
2) Znovu jsem použila Guldberg-Waagův zákon, dosadila a vyšlo mi:
3) Vůbec si nevím rady s tím, jak se rovnovážná konstanta počítá pomocí relativních tlaků...
Předem moc děkuji za rady :) Vím, že můj příspěvek je hodně dlouhý, moc děkuji všem, kdo se ho rozhodli přečíst a neodradil je délkou :)
Offline
- (téma jako vyřešené označil(a) Community)
#2 31. 10. 2015 23:28 — Editoval jelena (01. 11. 2015 09:15)
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakční kinetika
Zdravím,
příspěvek je dlouhý :-), ale dočteno, ovšem chybí v něm samotné výpočty (jen číselný výsledek se hůř ověřuje - obě můžeme mít překlep ve výpočtu a je to - zkusím to ráno přepočítat, pokud nebude souhlasit, tak ještě poprosím o doplnění postupu). Tak, jak jsi popsala, by to mohlo odpovídat vhodnému postupu výpočtu. Pro úlohu 3. budeš používat G-W zákon v úpravě pro parciální tlaky - viz např. předposlední řádek na 5. stránce v odkazu.
Jinak dle pravidel do tématu patří jen jeden dotaz viz pravidla - je to přehlednější pro diskusi, děkuji za pochopení.
Edit:
1) mám stejně -Odkaz
2) mám stejně - Odkaz
Offline
#3 01. 11. 2015 09:35
Re: Reakční kinetika
Moc děkuji :) příště se určitě polepším. Ten příspěvek je vážně moc dlouhý a bývalo by bylo lepší, kdybych to rozdělila do tří. Pokusím se napsat výpočty, ale přiznám se, že úplně nevím, jak je zapsat, tak to nějak zkusím, snad nebude vadit, když se mi to nepovede tak, jak má :)
1)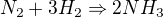
![kopírovat do textarea $[NH_3]^{2}$](/mathtex/9f/9f04873bd896cc1a13f704478e1add4c.gif)
![kopírovat do textarea $[0,412]^{2}$](/mathtex/d9/d9bfd8fc1744552a30dcf8eada9b250c.gif)
K = _________________ = ___________________ = 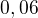
![kopírovat do textarea $[N_2][H_2]^{3}$](/mathtex/ca/caeeed775404b696af6fa17991dc126c.gif)
![kopírovat do textarea $[1,15][1,35]^{3}$](/mathtex/62/620d37070f53a9e4ac3a863bb3cde813.gif)
2)
![kopírovat do textarea $[HI]^{2}$](/mathtex/3a/3af13fbcb9440fdef699d48a37c5d128.gif)
46 = ___________
![kopírovat do textarea $[I_2][x]$](/mathtex/a9/a95554fba3b64da1b3cbe7af6eea31cd.gif)
![kopírovat do textarea $[HI]^{2}$](/mathtex/3a/3af13fbcb9440fdef699d48a37c5d128.gif)
![kopírovat do textarea $[x]$](/mathtex/21/21271f70d45cc2a593fb2a4b47a16998.gif) = ___________
= ___________
![kopírovat do textarea $[I_2]46$](/mathtex/fd/fdb594d75f744e7d3bb4ef91ab3fe35d.gif)
![kopírovat do textarea $[0,0027]^{2}$](/mathtex/39/39ecc0d6f2488261a422584f40b2b467.gif)
![kopírovat do textarea $[x]$](/mathtex/21/21271f70d45cc2a593fb2a4b47a16998.gif) = ______________
= ______________
![kopírovat do textarea $[0,0031]46$](/mathtex/ea/ea7c49ab5c94f28736afb92f6e893d24.gif)
![kopírovat do textarea $[x]= 0,000051122 mol/dm^{3}$](/mathtex/05/05fe8ff5be2aafb107b93c13ce7bdbaa.gif)
Offline
#5 01. 11. 2015 09:48
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakční kinetika
↑ Community:
děkuji, tak jsem se shodly, ozvi se s 3. příkladem. Napravo od okna zprávy máš Editor TeX, např. zlomek zapisuješ jako \frac{čitatel}{jmenovatel} , ale i tak je Tvůj zápis přehledný dost (+do budoucna jednu úlohu do tématu).
Offline
#8 01. 11. 2015 13:30
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Reakční kinetika
↑ Community:
ano, postupovala bych stejně, číselný výsledek mi také souhlasí.
Offline
![kopírovat do textarea $K_p=\frac{[SO_3]^{2}}{[SO_2]^{2}\cdot [O_2]}$](/mathtex/e7/e75ad3ddf6d0c6c9ccc819fd38320d64.gif)
![kopírovat do textarea $K_p=\frac{[0,988]^{2}}{[0,342]^{2}\cdot [0,173]}$](/mathtex/69/69a3fa9a9c0e7d681d1f0cc107e45ae8.gif)
