Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 27. 08. 2018 19:47
Vazba v molekule O2
Zdravím.
Když si nakreslím diagram molekulových orbitalů u molekuly O2, zjistím, že má dva nespárované elektrony. Počet vazeb spočítám jako polovinu rozdílu elektronů ve vazebných a protivazebných orbitalech - (8-4)/2 = 2. Vychází mi, že v molekule O2 se nachází dvě vazby. To mi však nejde dohromady se zjištěním, že molekula O2 má dva nespárované elektrony. Jak pak tedy může mít dvě vazby? V takovém případě by měla mít dva volné elektronové páry a žádné nespárované elektrony, ne?
Jinak u těch diagramů molekulových orbitalů tápu v jedné věci - jak poznám, jaké molekulové orbitaly se účastní vazeb a jaké ne? Nikde to nemůžu dohledat.
Offline
- (téma jako vyřešené označil(a) Bedlasky)
#2 28. 08. 2018 09:20
Re: Vazba v molekule O2
↑ Bedlasky: Ahoj :-), žasnem, že takéto niečo existuje aj pre širšiu obec ..
Odkaz
Offline
#3 28. 08. 2018 15:42 — Editoval Jozka2 (28. 08. 2018 15:43)
Re: Vazba v molekule O2
Re: Bedlasky
Zkusme to počítat jinak. Každý kyslík má ve valenční vrstvě 6 elektronů na 4 orbitalech. Jejich kombinací vzniknou 4 vazebné a 4 protivazebné orbitaly - 1*s a 3*p vazebný a protivazebný orbital. Oba s-orbitaly budou obsazeny elektronovým párem - celkem 4 elektrony. 3 vazebné p - orbitaly budou také obsazeny elektronovými páry, celkem 6 elektrony. Zbývající dva elektrony obsadí protivazebné orbitaly p, podle Hundova pravidla 2 po jednom elektronu, třetí protivazebný orbital zůstává prázdný.
Stačí?
Offline
#4 28. 08. 2018 15:54
Re: Vazba v molekule O2
↑ Bedlasky:
A ještě to tápání: kombinují se mezi dvěma atomy všechny orbitaly kromě těch, které se kombinují s jiným partnerem. Na příklad u CO2 má každý z obou kyslíků dva vazebné, dva protivazebné a dva nevazebné orbitaly. Centrální atom uhlíku kombinuje s orbitaly každého kyslíku své dva orbitaly. Chlor v HCl má jeden vazebný, jeden protivazebný a 3 nevazebné orbitaly.
Offline
#5 28. 08. 2018 16:59 — Editoval Bedlasky (28. 08. 2018 17:00)
Re: Vazba v molekule O2
↑ pietro:
Také mě to udivuje. Podobné 3D grafické modely mám rád, člověk si to na tom dokáže trochu lépe představit.
↑ Jozka2:
Díky, tohle mi moc pomohlo! :)
↑ Jozka2:
A proč se u toho kyslíku nevytvoří i nevazebné orbitaly? Všechny elektrony se přeci vazby neúčastní, ne? Navíc mi pořád není jasné, jak je to s tou vazností. Pokud má každý kyslík nespárovaný elektron, měl by mít jen jednu vazbu, ne?
Offline
#6 28. 08. 2018 20:40
Re: Vazba v molekule O2
↑ Bedlasky:
K vytvoření molekulových orbitalů se kombinují všechny orbitaly, které jsou u partnerů k dispozici. Jestliže se kyslík váže se dvěma vodíky, vytvoří s každým vazebný a protivazebný orbital. Zbylé dva orbitaly kyslíku se nemají s čím kombinovat, jsou tedy nevazebné.
V oxidu uhelnatém mají oba partneři 4 orbitaly, vytvoří se tedy 4 vazebné a 4 protivazebné orbitaly. Na ně se rozmístí 6+4 = 10 elektronů. 8 elektronů je na 4 vazebných orbitalech, jeden elektronový pár je na protivazebném orbitalu s. 3 protivazebné orbitaly p zůstávají prázdné. Každý ze čtyř orbitalů kyslíku má pro kombinaci partnera u atomu uhlíku. Naproti tomu v CO2 jsou u uhlíku pro vazby s každým kyslíkem k dispozici jen dva orbitaly. Dva orbitaly kyslíku se nemají s čím kombinovat, proto jsou nevazebné.
V molekule kyslíku má každý orbital jednoho kyslíku partnera v orbitalech druhého kyslíku, žádný orbital není nevazebný. Oba singl elektrony na protivazebných orbitalech p nepříslušejí žádnému z atomů kyslíku, jsou součástí molekulových orbitalů molekuly O2.Rozdíl mezi metodou VSEPR a metodou molekulových orbitalů je mimo jiné v tom, že metoda molekulových orbitalů nezná volné elektronové páry. Podle metody VSEPR jsou v molekule O2 u každého kyslíku dva volné elektronové páry. Na dvou orbitalech p, na kterých je u neutrálního atomu singl elektron, se vytvoří vazebné páry, jeden vazbou sigma, druhý vazbou pí. To, co je v metodě VSEPR volný pár, může být v teorii molekulových orbitalů nevazebný pár, ale i kombinace vazebný + protivazebný pár.
Offline
#7 28. 08. 2018 20:58 — Editoval Bedlasky (29. 08. 2018 00:53)
Re: Vazba v molekule O2
↑ Jozka2:
Aha, takže se v teorii MO nedají přiřadit elektrony k žádnému z atomů, ale pouze k celé molekule (resp. k jejím molekulovým orbitalům). Mě právě zmátl i tenhle obrázek, na který jsem narazil.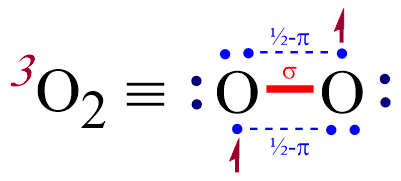
Tady to totiž vypadá, jako by ta druhá vazba byla v molekula O2 byla rozdělená mezi ty nespárované elektrony.
Edit: Je k tomu i text na anglické wiki, ale moc moudrý z toho nejsem: Odkaz
Edit 2: Nějak to nemůžu pustit z hlavy ani před spaním a asi mě napadlo, proč mám v některých věcech nejasnosti. K čemu je vazebný orbital je jasné - vytváří se v něm vazba. Jakou funkci má ale ten protivazebný? Vím akorát, že má vyšší energii, než ten vazebný. Nevím, proč jsem se nad touhle otázkou nepozastavil dřív. Možná by mi to všechno docvaklo mnohem rychleji. Omlouvám se, vím, že možná moje otázky zní hloupě, ale tahle látka je pro mě nová.
Offline
#8 29. 08. 2018 06:27 — Editoval Bedlasky (29. 08. 2018 06:59)
Re: Vazba v molekule O2
K tomu druhému editu - zkusil jsem se nad tím ještě zamyslet a asi už vím, jak to bude. Když se zaplňují vazebné orbitaly, snižuje se energie molekuly - tudíž je pro atomy výhodné mezi sebou vytvořit kovalentní vazbu. Pokud se začnou obsazovat elektrony do protivazebných orbitalů, začne to zvyšovat energii molekuly - začne to tedy kompenzovat původní snížení energie, které způsobilo obsazování vazebných orbitalů. Proto třeba nemůže vzniknout molekula He2 nebo Be2 - bylo by to pro ni energeticky nevýhodné. Nemluvě o tom, že helium by vlastně nemělo jak vytvořit vazbu, když má plně obsazené p orbitaly.
Když to tedy aplikuji na molekulu O2. Tady se zaplní elektrony, jak jste již výše zmiňoval - 4 elektrony obsadí vazebný i protivazebný sigma s orbital - tady se vlastně vlivem toho protivazebného orbitalu vykompenzuje to snížení energie. Potom se obsadí tři p vazebné orbitaly (jeden sigma a dva pí) 6 elektrony a nakonec po jednom elektronu do dvou protivazebných pí p orbitalů. Ty dva elektrony v protivazebných pí orbitalech vykompenzují snížení energie způsobené obsazením jednoho vazebného pí orbitalu elektrony. To znamená tedy, že jsou v molekule dvě vazby - jedna sigma a jedna pí. Sigma vazba se nachází ve vazebném sigma orbitalu, pí vazba ve vazebném pí orbitalu.
Chápu to tak správně?
Jinak mě ještě tak napadlo - kdybych chtěl nakreslit Lewisovu strukturu molekuly O2, tak se v ní nachází tři elektronové páry neúčastnící se vazby a dva volné elektrony. Takže by byla mezi kyslíky dvojná vazba, každý atom by pak měl u sebe jeden nespárovaný elektron a jeden kyslík by měl jeden elektronový pár a ten druhý dva (vlivem čehož by musel být na prvním formální náboj + a na druhém -). Nebo je ta představa mylná?
Offline
#9 29. 08. 2018 13:19 — Editoval Jozka2 (29. 08. 2018 14:03)
Re: Vazba v molekule O2
↑ Bedlasky:
S tou molekulou kyslíku a její Lewisovou strukturou ta máš trochu pomotané. Především - Lewisova struktura nerozlišuje sigma a pí vazbu. Vazba je znázorněna dvěma tečkami mezi partnerskými atomy, volný elektronový pár je znázorněn dvojtečkou mimo spojnici obou atomů. U O2 jsou mezi oběma atomy dvě dvojtečky - dvojná vazba (čtyři sdílené elektrony na dvou orbitalech, z nichž jen jeden je podle VSEPR hybridizovaný). U každého atomu jsou dál dvě dvojtečky volných elektronových párů. Každý z obou atomů má 2 páry sdílených elektronů a dva volné elektronové páry. V molekule není žádný singl elektron. Každý z obou atomů má oktet, tvořený dvěma volnými a dvěma sdílenými páry.
Ten tvůj obrázek mi připadá trochu matoucí. Jako by jedna vazba pí byla tvořena čtyřmi elektrony. Patrně je k jeho pochopení potřeba výklad v anglickém textu. Ale já angličtinou nevládnu.
Offline
#10 29. 08. 2018 19:13 — Editoval Bedlasky (29. 08. 2018 19:17)
Re: Vazba v molekule O2
↑ Jozka2:
V tom článku je ještě jeden odkaz hovořící konkrétně o té vazbě. No, z toho, co jsem pochopil, se jedná o vazbu, ve které je sdílený jeden elektron. Ten elektron v protivazebném pí orbitalu zvyšuje energii vazebného orbitalu, takže ho jako by napůl "deaktivuje" (vím, to asi není úplně to ideální slovní spojení, ale nenapadá mě, jak jinak to vyjádřit). Nazývají to jako tříelektronovou vazbou, nebo tam také používají označení "půltá" vazba. Vyskytuje se to právě u takových molekul, jako je O2, NO, ClO2 apod. Existuje prý i vazba, které se účastní jeden elektron - např. u iontu H2+. Při hledání na googlu jsem ještě narazil na odkaz na jedno chemické fórum, kde bývají témata pěkně vysvětlená. Bohužel se mi tam teď nějak nejde dostat, asi mají nějakou poruchu. Zkusím se na to podívat jindy, jestli se tam tedy půjde dostat. Pokud k tomu zjistím ještě něco dalšího, napíšu to sem. Nicméně mám poměrně nabitý víkend, takže to sem vložím až v průběhu příštího týdne.
Jinak tam k té vazbě mají i obrázek:
Jinak děkuji moc za trpělivost a vysvětlení všech mých dotazů :).
Offline
#11 30. 08. 2018 17:55
Re: Vazba v molekule O2
No, tak jsem se včera večer dozvěděl, že mi víkendový program nakonec odpadá, tak jsem se na to podíval dneska.
No, upřímně z toho nově přečteného nejsem vůbec moudrý. Ta tříelektronová vazba se prý údajně vyskytuje i v benzenu. Ale nevím, nějak jsem to vysvětlení nepobral. Pokud by se na to nějaký zájemce chtěl podívat, našel jsem to tady, jsou tam k tomu i obrázky:
https://www.quora.com/What-is-a-three-electron-bond
Offline
