Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 30. 01. 2019 12:00
Plyny
Dobrý deň. Chcel by som sa opýtať na Avogadrovú konštantu a mol plynu. mol je charakterizovaný ako objem plynu 22,711L ktorý obsahuje počet atómov plynu rovnajúcej sa Avogadrovej konštante pri 273,15°K a tlaku 100000 Pa.
Avogadrová rovnica má tvar 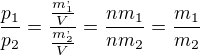 Keď si vložíme do tej rovnice za n avogadrovú konštantu a za V mol plynu ale plyny by mali mať rôznu atómov hmotnosť m1 sa nerovná m2. Samozrejme teplota by bola 273,15°K. Podľa definície molu by museli byť tlaky p1 a p2 rovnaké. Druhá otázka je ohľadom rozkladu vody na kyslík a vodík. Pokiaľ máme učkovú banku a elektródy sú umiestnené v dvoch kolmých stĺpcoch tak vidíme, že vodík bude mať dvojnásobný objem ako kyslík. Znamenalo by to, že vodík musí mať rovnako veľké atómy ako kyslík pri rovnakých podmienkach pretože objem vodíka je dvojnásobný tlak vodíka musí vyrovnať aj väčšiu hmotnosť kyslíka. Môžete my to vysvetliť ohľadom molu a tlaku vodíka pri elektrolýze vody? Majú rôzne plyny pri rovnakých podmienkach rovnako veľké atómy?
Keď si vložíme do tej rovnice za n avogadrovú konštantu a za V mol plynu ale plyny by mali mať rôznu atómov hmotnosť m1 sa nerovná m2. Samozrejme teplota by bola 273,15°K. Podľa definície molu by museli byť tlaky p1 a p2 rovnaké. Druhá otázka je ohľadom rozkladu vody na kyslík a vodík. Pokiaľ máme učkovú banku a elektródy sú umiestnené v dvoch kolmých stĺpcoch tak vidíme, že vodík bude mať dvojnásobný objem ako kyslík. Znamenalo by to, že vodík musí mať rovnako veľké atómy ako kyslík pri rovnakých podmienkach pretože objem vodíka je dvojnásobný tlak vodíka musí vyrovnať aj väčšiu hmotnosť kyslíka. Môžete my to vysvetliť ohľadom molu a tlaku vodíka pri elektrolýze vody? Majú rôzne plyny pri rovnakých podmienkach rovnako veľké atómy?
Offline
#2 30. 01. 2019 12:45
Re: Plyny
Co píšeš je nejspíš nesmysl - protože tlak (ideálního) plynu na hmotnosti molekul nezávisí. Stavová rovncie plynu je
tlak závisí jen na počtu částic, jejich energii (to je ta teplota) a objemu, který zabírají.
A pokud mě paměť příliš neklame, tak to není poprvé, co vydáváš nějaký (relativně nesmyslný) vztah za seriózní,
takže jak už jsem minimálně jednou upozorňoval, začal bych tím, kam na ta moudra vlastně chodíš.
Já třeba (a wiki taky) jsem o žádné "Avogadrovej rovnici" nikdy neslyšel...
Offline
#4 30. 01. 2019 12:58
Re: Plyny
↑ edison:
Existují i jiné modely plynu než je stavová rovnice ideálního plynu. Nejznámější je asi Wan der Waalsova rovnice, která zohledňuje právě to, že molekuly plynu nezabírají nulový objem (což se projeví při vyšších tlacích - že tlak roste při stlačování rychleji než u ideálního plynu) a také to, že na sebe molekuly působí přitažlivými silami - což se projeví například Joule-Thomsonovým efektem - že při expanzi do volného prostoru plyny snižují (nebo také zvyšují) svoji teplotu. To by ideální plyn také nedělal.
Offline
#7 30. 01. 2019 14:51 — Editoval Kenniicek (30. 01. 2019 14:56)
Re: Plyny
Molarny objem je objem plynu vztiahnuty na mol, takze V_m = V/n Je to z dovodu, aby sa objem nejakej latky (extenzivna velicina) udaval ako intenzivna velicina (molarny objem). Urceny je z toho, ze sa do rovnice V_m = RT/p dosadi dana hodnota tlaku a teploty.
Okrem VdW rovnice existuje este napriklad presnejsia Redlich-Kwongova rovnica realneho plynu, alebo casto sa pouziva virialny objemovy rozvoj.
Offline
#8 30. 01. 2019 15:57
Re: Plyny
v tej prvej otázke som sa pomýlil. Avogadrová konštanta udáva koľko je častíc v jednom móle plynu alebo v 12g uhlíka z atómovým číslom 12. atóm uhlíka je 12x ťažší ako atóm vodíka. myslím, že 1g vodíka pri 273,15°K a 100000 Pa má objem 22,711L. Nachádza sa v ňom počet atómov rovný hodnote Na. tak isto sa bude rovnať počet atómov ktoré sú 12x ťažšie v 12 gramoch. Ďakujem za odpovede
Offline
#9 30. 01. 2019 16:14
Re: Plyny
marostul napsal(a):
Avogadrová konštanta udáva koľko je častíc v 12g uhlíka z atómovým číslom 12.
Tohle je určitě pravda.
marostul napsal(a):
atóm uhlíka je 12x ťažší ako atóm vodíka.
Tohle je pravda jen přibližně, ve skutečnosti je to 12/1,00794 = 11,905. Není to úplně zanedbatelný rozdíl...
Ale jinak je to jak říkáš. Jen je dobré vědět, že hmotnosti atomů neodpovídají úplně přesně vztahu počet částic krát hmotnost částic. Jádra jsou lehčí o vazebnou energii, která se uvolnila, když jádro vznikalo.
Pak je ještě jeden trik - a na t jsem myslel, že se vlastně ptáš - jak lze vlastně tu Avogadrovu konstantu určit, jak lze spočítat, kolik atomů v těch 12 gramech uhlíku vůbec je. Není to vůbec triviální, a chemici to po nějakou nevěděli. Prostě věděli, že je tam "mol" částic, a nevěděli, kolik to je.
Offline
