Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 24. 05. 2019 03:08 — Editoval DavidMath (24. 05. 2019 03:09)
Vysrážení CaCO3 (Související s Tvrdostí vody)
Dobrý den všem.
Mohl bych mít, prosím, dotaz na tento příklad, na který jsem narazil v zadání zkouškové písemky z Analytické chemie?
Zadání:
Kolik CaCO3 by se vysráželo z 10 litrů vody, pokud je trdost vody 11,2 °dH? (1° dH = 1 mg CaO ve 100 ml vody).
Celkově to navazuje na tvrdost vody a už velmi dlouho si s výpočtem tvrdosti vody (Ca2+ a Mg2+) lámu hlavu a asi na to s pomocí nepřijdu.
Na tento příklad související s tvrdostí vody nejspíš taky sám nespočítám.
Já si napsal a zjistil dle tabulek, že 1 mmol/l = 5,6 °dH, takže jsem si vypočítal pomocí trojčlenky, že:
1 mmol/l ..... 5,6 °dH
x mmol/l ..... 11,2 °dH
____________________
x = 2 mmol/l je tedy tvrdá voda ze zadání (akorát přepočítaná) snad správně.
No a pak jsem počítal už dle vzorečku: c = m/M*V
m(CaCO3) = M * V * c = 100,087 g/mol (což je molekulová hmotnost CaCO3) * 10 litrů * 2*10^-3 mol/l
m(CaCO3) = 2,00174 g
To znamená, že by se vysráželo v 10 litrech vody při tvrdosti vody 2 mmol/l (11,2 °dH) těch 2,000174 g?
Přijde mi to jako nesmysl, ale jinak mě způsob počítání nenapadá.
Kažopádně jakmile vyřeším spolu s Vámi tento příklad, rád bych celkově s Vámi, prosím, pořešil výpočet tvrdosti vody, neboť to se ve zkoušce rovněž může objevit a celkově mě to i zajímá z vlastního zájmu.
Děkuji
Offline
#2 24. 05. 2019 10:29 — Editoval Bedlasky (24. 05. 2019 10:29)
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ DavidMath:
Zdravím.
Máte to správně. To, že 1mmol/l = 5,6°dH jste ale nemusel ani hledat. Na výpočet stačí pouze zadané údaje.
1°dH = 1mg CaO/100ml = 10mg CaO/1l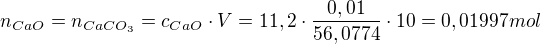
m(CaCO3) = 0,01997×100.0869 = 1,999g
Pokud chcete hodnotu ještě přesnější, musíte vzít v potaz součin rozpustnosti.
CaCO3 <--> Ca2+ + CO3(2-)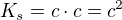

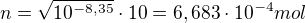
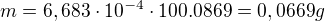
m(CaCO3) = 1,999-0,0669 = 1,9321g
Offline
#3 25. 05. 2019 00:02
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ Bedlasky:
Super, díky. Akorát nechápu moc výrazu následujícímu:
To, že n(CaO) = n(CaCO3) je jasné, zkrátka látková množství se rovnají.
Dále zápisu už ale tolik nerozumím. látkové množství (n) je přece c * V, což máte. Pak ale nechápu, proč za rovná se máte dále více údajů, které nemohu dát dohromady. Nejdříve jsem myslel, že se jedná o vzorec hmotnostní koncentrace spojení s běžným n = c * V dohromady, ale neumím si to odvodit a asi to tak nebude.
Proč máte tedy: n = c(CaO) * V a dále = 11,2 * 0,01/56,0074 * 10 ?
11,2 chápu, to je koncentrace CaO (sice nevím, zda se píše nějaká jednotka, nebo je to bezrozměrná veličina, když je °dH, no a dle vzorečku n(CaO) = c * V bych tedy doplnil do vztahu jen koncentrace násobený objemem, ne?
Proč jsou tam tedy údaje navíc, jako 0,01/56,0074, které ve vzorečku, do kterého doplňujeme, nejsou?
pochopil jsem, že 0,01 přepočet 10 mg na gramy a že 56,0074 bude nejspíš molekulová hmotnost CaO, takže je to tedy hmotnost dělená molekulovou hmotností, takže samotné látkové množství CaO. Následně je vše ještě násobeno * 10, tedy nejspíš objemem, což bude asi zase objem 10 litrů vody?
Kompletně takto ten vzoreček či vztah spojený dohromady nějak nechápu. Mohl byste mi to, prosím, nějak rozepsat? Klidně i s jednotkami. Díky moc
Offline
#4 25. 05. 2019 00:15 — Editoval DavidMath (25. 05. 2019 00:16) Příspěvek uživatele DavidMath byl skryt uživatelem DavidMath. Důvod: Moje chyba, je to správně!
#5 25. 05. 2019 15:31 — Editoval Bedlasky (25. 05. 2019 15:36)
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ DavidMath:
Omlouvám se, asi jsem to měl víc rozepsat.
11,2*0,01/56,0774 - to celé je koncentrace CaO.
V zadání je, že 1 °dH se rovná koncentraci (hmotnostní koncentraci) 1mg CaO/100ml = 10mg CaO/1l vody. Jenže na výpočet potřebujeme molární koncentraci. Proto jsem si přepočetl těch 10mg CaO na moly (to je to 0,01/56,0774).
Pokud bychom to brali trochu exaktněji, lze napsat:
Z čehož pak nakonec vyjde vztah: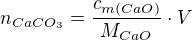
Po dosazení: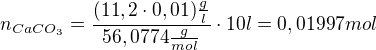
Offline
#6 25. 05. 2019 16:46
#7 23. 06. 2019 03:24
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ Bedlasky:
Mohu se, prosím, ještě jen zeptat, kde jste prosím vzal to 10^-8,35 ?
vím, že c^2 = je rovno odmocnině součinu rozpustnosti Ks
Ale proč 10 na -8,35?
Prosím o podrobnější vysvětlení, děkuji mnohokrát
Offline
#8 23. 06. 2019 07:50
#9 23. 06. 2019 11:12 — Editoval DavidMath (23. 06. 2019 11:13)
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ Bedlasky:
Dobrý den.
Je právě záhadou, že v tabulkách, které používám, žádnou takovou hodnotu nemohu najít.
Používám tabulky KÜSTER-THIEL Chemicko analytické výpočetní tabulky.
na 203-209 jsou rozpustnosti a součiny rozpustnosti.
Předpokládám, že rozpustnost je pKs a součin rozpustnosti Ks.
V tabulce mám pouze součin rozpustnosti (Ks) CaCO3 = 0,87*10^-8
Proto mě zajímá, jak zjistím hodnotu 8,35 (pKs). Navíc 10^-8,35 nedá číslo 0,87*10-8, ale 4,46*10^-9 :(
Děkuji :)
Offline
#10 24. 06. 2019 07:23
Re: Vysrážení CaCO3 (Související s Tvrdostí vody)
↑ DavidMath:
pKs není rozhodně rozpustnost. Někdo značí rozpustnost c někdo s a má jednotky mol/l.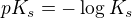
Údaje jsou z chemicko-analytických tabulek od Vohlídala. Zdroje se bohužel v hodnotách součinů rozpustnosti někdy liší. Stačí se podívat sem. Tady taky najdete trochu jiné hodnoty.
Offline
