Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 25. 05. 2019 20:28 — Editoval DavidMath (25. 05. 2019 20:42)
Vzorečky pro zásaditý a kyselý pufr
Dobrý den,
omlouvám se, že obtěžuji poměrně s takovou banalitou, ale opravdu mě to zajímá a odvodit sám si to nedovedu. Snad to tedy bude užitečné případně i pro ostatní, kteří na tohle téma narazí.
Při počítání příkladů na zkoušku z Analytické chemie jsem narazil na zvláštní typ vzorečku. První jsem si říkal, zda to není chyba a zda se vyučující nějak nespletl, nakonec jsem pak zjistil, že vzoreček, který jsme v průběhu semestru v semináři nikdy nepoužívali, opravdu existuje. Tento vzoreček jsem objevil v materiálech od vyučujícího, kde je jeden zkouškový test ukázkový i s postupem počítání a řešením.
Vzoreček pro kyselý pufr, tedy ten, který obsahuje sůl silné kyseliny a slabé zásady (většinou tedy), tak jeho tvar je následující a celý semestr jsme jej používali, takže pro mě známý:
pH = pKa + log (cs/ca) tedy koncentrace soli nebo slabé zásady dělená koncentrací kyseliny
Poté jsem narazil na zvláštní typ vzorečku, který má 3 podoby, a to na vzoreček pro zásaditý pufr:
pOH = pKb + log (cs/cb) tedy koncentrace soli nebo slabé kyseliny dělená koncentrací zásady
Konkrétně uvedu i pomocí příkladu, kdy hodnota koncentrace zásady byla vypočítána na 0,552 mol/l a koncentrace soli 0,4042 mol/l. Zásada je roztok NH3 a sůl je přidaný síran amonný (NH4)2SO4:
po dosazení do vzorečku:
pOH = pKb + log (cs/cb)
pOH = 4,75 + log (0,4042/0,552) = 4,615
pH = 14 - pOH = 14 - 4,615 = 9,38
To byla první možnost výpočtu dle ještě celkem pro mě pochopitelného vzorečku i postupu.
Jenže pak jsem nalezl na internetu další vzoreček, který je ale odlišný od vzorečku, který uvádí vyučující v materiálech ke zkoušce s výpočty. Jedná se v podstatě o rychlejší způsob vzorečku pro rychlejší výpočet, než dle prvního, co jsem uvedl nahoře, neboť tam bych první musel spočítat pOH a následně odečtením 14 - pOH spočítat pH. Tyto jsou asi pro rychlejší výpočet.
1) První tedy ten, co jsem našel na netu:
pH = 14 - pKb - log (cs/cb) což samozřejmě chápu, že 14 - pkb je tvar pro pka, protože (pka + pkb = 14)
když dosadím, vše vyjde stejně: pH = 14 - 4,75 - log (0,4042/0,552) = 9,38
2) Nyní vzoreček dle vyučujícího, který je v podstatě skoro stejný, jen se liší od znaménka s tvarem logaritmu a popravdě nevím, proč tomu tak je a jak si to odvodit:
pH = 14 - pkb [b]+ log (cb/cs)[/b] Po dosazení opět vyjde 9,38. Otázkou je spíše, proč nebo jak mohu vědět, že mohu použít i místo - log (cs/cb) i kladnou hodnotu logaritmu s převráceným zlomkem + log (cb/cs) ???
Já myslel, že když vynásobím jakoby logaritmus mínus jedničkou * (-1), abych se zbavil toho mínuska, že vznikne zkrátka jen kladný logaritmus, ale proč se tedy přehodil i podíl koncentrace soli (nebo slabé kyseliny) a koncentrace zásady na zlomek koncentrace zásady ku koncentraci soli (slabé kyseliny)?
V podstatě kvůli tomu jsem položil tento dotaz. Díky moc!
Offline
- (téma jako vyřešené označil(a) DavidMath)
#2 25. 05. 2019 21:49 — Editoval Bedlasky (25. 05. 2019 21:57)
Re: Vzorečky pro zásaditý a kyselý pufr
↑ DavidMath:
Zdravím.![kopírovat do textarea $\log_{}\frac{a}{b}=\log_{}[(\frac{b}{a})^{-1}]=-log\frac{b}{a}$](/mathtex/83/83b335dd0cf857bbd380b0dea7f51492.gif)
DavidMath napsal(a):
koncentrace soli 0,4042 mol/l. Zásada je roztok NH3 a sůl je přidaný síran amonný (NH4)2SO4
Pokud se ta koncentrace vztahuje k (NH4)2SO4, pak je koncentrace NH4+ dvakrát taková. Počítá se s koncentrací NH4+ (podívejte se co figuruje v rovnovážné konstantě).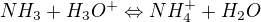
![kopírovat do textarea $K=\frac{[NH_{4}^{+}]}{[NH_{3}]\cdot [H_{3}O^{+}]}$](/mathtex/cc/ccc215d33a5c5ae7c61ca4c49fe64b85.gif)
Offline
