Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 14. 04. 2017 17:20
Pravděpodobnost průběhu reakce
Zdravím.
Říkal jsem si, co by mohlo vznikat při rozpouštění mědi v kyselině chloristé. Napadly mě tyhle tři rovnice: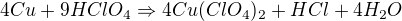
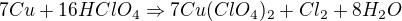
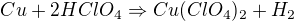
Šlo by nějak teoreticky určit, jaká z těch reakcí bude nejpravděpodobněji probíhat?
Offline
- (téma jako vyřešené označil(a) Bedlasky)
#2 14. 04. 2017 19:42
Re: Pravděpodobnost průběhu reakce
↑ Bedlasky:
Zdravím,
to poslední rozhodně ne. Plynný vodík by měďnatou sůl opět zredukoval na měď (ušlechtilé kovy, které mají vyšší redox potenciál, než vodík, se nerozpouští v kyselinách za vzniku vodíku).
Jestli vznikne HCl nebo Cl2 bude záviset mj. i na koncentraci kyseliny, resp. přesněji na pH roztoku.
Nastudujte si Latimerovy a Frostovy diagramy a Nernstovu rovnici :-)
Stačí takto?
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
#3 15. 04. 2017 21:55
Re: Pravděpodobnost průběhu reakce
↑ houbar:
Zdravím.
Co se týče Latimerových a Frostových diagramů, našel jsem o nich akorát něco tady. Konkrétně jsem z toho pochopil, jak to sestavit (u těch Frostových diagramů to N.E° na ose y - N znamená oxidační číslo?). Co jsem tak nějak pochopil, tak ve Frostově diagramu vidím, jak moc je stabilní prvek v nějakém oxidačním čísle oproti jiným jeho oxidačním číslům. V Latimerově diagramu zase stand. elektrodové potenciály mezi jednotlivými reakcemi. V čem konkrétně mi to ale pomůže, to netuším.
Co se týče Nernstovy rovnice a pH, našel jsem pěkný materiál tady. To odvození formálního elektrodového potenciálu na základě pH jsem pochopil, vrtá mi ale hlavou jiná věc. Kde v tom výpočtu po dosazení použili střední aktivní koeficienty? Pokud vím, tak to 0,0592 je přibližná hodnota, která vyjde z 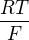 a převodu na dekadický logaritmus. Takže nevím, kam se tohle ztratilo. Navíc jsem našel výpočty pro střední aktivní koeficienty, které se dají použít jen do koncentrace 0,01 mol/l. Celkový elektrodový potenciál reakce v tomhle asi není důležitý, nebo snad ano? V materiálu výše počítali jen ten formální. A v čem dalším mi Nernstova rovnice může pomoci netuším. Poradíte mi prosím, co konkrétně bych si měl ještě nastudovat?
a převodu na dekadický logaritmus. Takže nevím, kam se tohle ztratilo. Navíc jsem našel výpočty pro střední aktivní koeficienty, které se dají použít jen do koncentrace 0,01 mol/l. Celkový elektrodový potenciál reakce v tomhle asi není důležitý, nebo snad ano? V materiálu výše počítali jen ten formální. A v čem dalším mi Nernstova rovnice může pomoci netuším. Poradíte mi prosím, co konkrétně bych si měl ještě nastudovat?
Offline
#4 07. 03. 2021 00:20
Re: Pravděpodobnost průběhu reakce
Tak trochu jsem si dnes vzpomněl na tento svůj starý dotaz a napíšu sem odpověď pro případ, že by někoho takové ptákoviny zajímaly :).
Pokud budeme uvažovat reakci mědi s azeotropickou HClO4 (72%, běžně prodávaná koncentrace), tak by neproběhla žádná reakce, protože kyselina chloristá je do nějakých 75% koncentrace plně disociovaná a chová se jako běžná silná kyselina bez oxidačních účinků. Oxidační vlastnosti jsou způsobeny až přítomností nestabilních kovalentních molekul HClO4.
Pokud bychom uvažovali reakci mědi s čistou HClO4, nejspíš by nedošlo téměř k žádné reakci kvůli vzniku pasivační vrstvy chloristanu měďnatého. Nicméně pokud bych měl vyjít z nějakých praktických zkušeností, tak z toho, s čím jsem pracoval, má nejblíž čisté HClO4 dýmavá HNO3, která taktéž téměř nereaguje s mědí. Nicméně pár kapek vody reakci spolehlivě nastartuje. Obdobné chování bych očekával i u směsi čisté HClO4 a mědi. Existuje několik různých produktů, na které by se mohla kyselina chloristá redukovat a to: HClO3, ClO2, Cl2 a HCl. HClO3 je nad 30% nestabilní a okamžitě se rozkládá (ve větších množstvích explozivně):
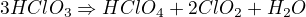
ClO2 je relativně stabilní produkt redukce, stejně tak chlor. HCl má redukční vlastnosti a reagoval by jak s HClO4, tak s případnou intermediátní HClO3:
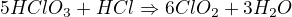
Tudíž jedinými stabilními a finálními produkty redukce HClO4 by byly ClO2 a Cl2. Rovnice pro reakci mědi dejme tomu s 90% HClO4 jsou tedy: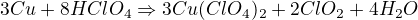

Z praktického hlediska pohledu bych tuto reakci ale nepovažoval za příliš bezpečnou. V nějakém malém množství ve zkumavce by to asi bylo bezpečně uskutečnitelné, ale určitě ne ve větším množství, vzhledem k tomu, že čistá HClO4 reaguje s redukčními činidly explozivně, HClO3 se explozivně rozkládá a ClO2 je nad 10 objemových % ve vzduchu explozivní.
Offline

