Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 29. 05. 2021 22:01 — Editoval Masulin (29. 05. 2021 22:09)
Termodynamika_stavové rovnice
Ve dvou uzavřených nádobách stejného objemu V je stejný druh ideálního plynu. V první nádobě je tlak p1 = 200kPa a teplota T1 = 250K a ve druhé tlak p2 = 150 kPa, teplota T2 = 300K.
Najděte poměr hmotností plynu v první a druhé nádobě.
Zdravím, mám zde jeden přijímačkový příklad na stavové rovnice (p*V)/T=(p*V)/T. Zkoušel jsem je sestavit, vypočítat počet molů (Ze vzorečku přes Avogardovo číslo) a tak dále, ale bohužel se mi to nedaří. Vím, že se nejspíše jedná o triviální příklad, ale potřeboval bych s ním pomoci.
Děkuji
PS: Ještě jsem uvažoval o řešení přes dosazení m=V*ρ ale nevím
Offline
- (téma jako vyřešené označil(a) Masulin)
#2 29. 05. 2021 23:30
Re: Termodynamika_stavové rovnice
↑ Masulin:
Postup, který naznačuješ, je v principu správný. Když dosadíš za počet molů, platí a
a 
zbytek je skutečně triviální
Pořádek je pro blbce, inteligent zvládá chaos!
Offline
#3 30. 05. 2021 00:08
Re: Termodynamika_stavové rovnice
Super, děkuji
Myslel jsem si, že při stálém objemu tento vzorec použít nemohu. Jinak řečeno, rozumím tomuto zápisu, ale nevím jak s ním naložit. Jelikož
1. Nevím o jaký se jedná plyn - je stejný pro obě nádoby
2. Objem je konstantní
3. Vzoreček kde se používá mol. hmotnost nebo Avogardovo číslo nefunguje, jelikož nevím jaký je to plyn.
Tím pádem, jsem spíš přemýšlel, že to bude klasická forma sestavení statové rovnice jako třeba: 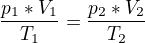
Ve které nehraje roli objem, který mohu vyjádřit jako 
Offline
#4 30. 05. 2021 07:12
Re: Termodynamika_stavové rovnice
↑ Masulin:
1. + 2. Ano.
3. Zkusil jsi to? Co kdybys třeba ty dvě rovnice vydělil.
Vztah  , ti nepomůže, protože neznáš hustotu, a ta není konastantní.
, ti nepomůže, protože neznáš hustotu, a ta není konastantní.
Pořádek je pro blbce, inteligent zvládá chaos!
Offline
#5 30. 05. 2021 13:02
Re: Termodynamika_stavové rovnice
Možná je jednodušší na pochopení vzít tu "nemolovou" stavovou rovnici, tedy
[mathjax]pV = NkT[/mathjax]
Takže máš
[mathjax]p_1V = N_1kT_1[/mathjax]
[mathjax]p_2V = N_2kT_2[/mathjax]
Podělením rovnic dostaneš, že poměr počtu částic se rovná...(něčemu)
[mathjax]\frac{N_1}{N_2}=...[/mathjax]
Zbývá (nejlépe selským rozumem) doložit, že když jde o stejný plyn (stejné atomy) tak poměr jejich počtu bude odpovídat poměru jejich hmotností... mě to přijde celkem samozřejmé...
Ale samozřejmě, když vydělíš ty rovnice, co napsal Zdenek, dostaneš to samé...
Offline
