Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 10. 01. 2016 18:11
Chemický výpočet
Prosím, potřebovala bych poradit, vůbec nevím, jak to spočítat, jestli využít hmotnostní zlomek nebo látkové množství?
Vypočtěte hmotnost hydroxidu draselného (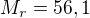 ), která je potřebná k přípravě 5g síranu draselného (
), která je potřebná k přípravě 5g síranu draselného (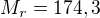 ) neutralizací odpovídajícího množství kyseliny sírové.
) neutralizací odpovídajícího množství kyseliny sírové.
Děkuji
Offline
#3 11. 01. 2016 19:49 — Editoval Vickey (11. 01. 2016 19:50)
Re: Chemický výpočet
↑ Bedlasky:
Ahá jasně ke správnému výsledku jsem došla, ale hlava to nějak nepobírá. Nechápu toto:
Pro mě tento zápis trojčlenky znamená:
Mám K2SO4, jehož molární hmotnost je 174,3g a skutečná hmotnost 5g čili 174,3g ... 5g
A otázka se ptá kolik KOH budu potřebovat k jeho přípravě, tzn., 2*56,1 ... Xg
Jenomže, jak to takhle mohu počítat vždyť KOH nemá žádnou síru, která pak je v K2SO4 a naopak K2SO4 nemá žádný vodík, který KOH má...
Nechápu to...
Offline
#4 11. 01. 2016 20:58 — Editoval jelena (11. 01. 2016 20:59)
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Chemický výpočet
Zdravím,
podle reakce od kolegy 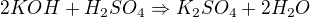 platí, že z 2 mol KOH vznikne 1 mol K2SO4. Toto bude první řádek trojčlenky. Druhý řádek bude, že z vypočteného mol KOH vznikne (m/M_r(K2SO4)) mol. Doplňuješ to, co máš dle zadání, co nemáš, označuješ x.
platí, že z 2 mol KOH vznikne 1 mol K2SO4. Toto bude první řádek trojčlenky. Druhý řádek bude, že z vypočteného mol KOH vznikne (m/M_r(K2SO4)) mol. Doplňuješ to, co máš dle zadání, co nemáš, označuješ x.
kolegův zápis bych přečetla, že skutečná hmotnost KOH je v takovém poměru k 5g K2SO4, jako hmotnost 2 mol KOH k hmotnosti 1 mol K2SO4. Moderní postupy vyžaduji počítat přes látkové množství a odpovídající vzorce. Já počítám zastaralou metodikou, že nad reakci napíší počty mol dle reakce (stechiometricky) a rovnou přepočtu na údaje, podle kterých mám počítat v zadání (potřebuji počítat hmotnost, tak počty mol vynásobím M_r). Potom do dolního řádku zapisuji skutečnost dle zadání, tak už trojčlenku mám před sebou. Jinak v úvodním tématu je hodně různých typů úloh. Stačí tak? Děkuji.
Offline


