Matematické Fórum
Nevíte-li si rady s jakýmkoliv matematickým problémem, toto místo je pro vás jako dělané.
Nástěnka
❗22. 8. 2021 (L) Přecházíme zpět na doménu forum.matweb.cz!
❗04.11.2016 (Jel.) Čtete, prosím, před vložení dotazu, děkuji!
❗23.10.2013 (Jel.) Zkuste před zadáním dotazu použít některý z online-nástrojů, konzultovat použití můžete v sekci CAS.
Nejste přihlášen(a). Přihlásit
#1 19. 02. 2016 14:46
Součin rozpustnosti
Vypočtěte součin rozpustnosti  pro
pro  ze známé rozpustnosti, která činí přibližně 16,8g
ze známé rozpustnosti, která činí přibližně 16,8g  ve 100ml roztoku.
ve 100ml roztoku.
_________________________________________________________________________________________________________________
Nejdříve jsem si sestavila rovnici:
Vypočítala jsem si látkové množství:

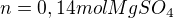
Pak jsem počítala koncentraci: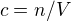

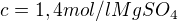
A pak jsem to dosazovala do vzorce pro 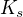
![kopírovat do textarea $K_{s}=[Mg^{2+}]^{1}[SO_{4}^{2-}]^{1}$](/mathtex/19/197c22fc9edcdaeca277b297a8cb7fa4.gif)
![kopírovat do textarea $K_{s}=[1,4]^{1}[1,4]^{1}$](/mathtex/8e/8ec73fbe98dfb65f4493cc47fab59e8e.gif)

A  spočítám jako záporný dekadický logaritmus:
spočítám jako záporný dekadický logaritmus:
Někde jsem udělala nějakou zásadní chybu, protože mi to vychází divně, ale vůbec nemůžu najít kde... Mohla bych moc poprosit o pomoc? :)
Děkuji
Offline
#2 19. 02. 2016 23:15
- jelena
- Jelena
- Místo: Opava
- Příspěvky: 30020
- Škola: MITHT (abs. 1986)
- Pozice: plním požadavky ostatních
- Reputace: 100
Re: Součin rozpustnosti
Zdravím,
já jsem žádnou chybu nenašla. MgSO4 patří k dobře rozpustným solím, tedy u něho počítat  povede k výsledku, jak máš (obdobně by dopadl záměr počítat pH 2M kyseliny např.). Ale počkej ještě na kolegy, kolega houbar dokonce možná tuto úlohu řešil jako domácí přípravu k CHO.
povede k výsledku, jak máš (obdobně by dopadl záměr počítat pH 2M kyseliny např.). Ale počkej ještě na kolegy, kolega houbar dokonce možná tuto úlohu řešil jako domácí přípravu k CHO.
Offline
#3 20. 02. 2016 10:56
Re: Součin rozpustnosti
Ahojte :-),
a či by sa tam nemali "zamontovať" aktivity a aktivitné koeficienty ?, namiesto koncentrácií,
aj s použitím Debye-Huckel
https://en.wikipedia.org/wiki/Debye%E2% … l_equation
Offline
#4 20. 02. 2016 15:18
Re: Součin rozpustnosti
↑ jelena:
No asi mne zmátl ten záporný logaritmus, protože mi to pak nějak vychází celé záporně :D 
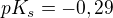
A třeba  je podle tabulek
je podle tabulek  , je to samozřejmě mnohem méně rozpustný síran, ale stejně si myslím, že mi ten hořečnatý vychází nějak špatně...
, je to samozřejmě mnohem méně rozpustný síran, ale stejně si myslím, že mi ten hořečnatý vychází nějak špatně...
Offline
#6 21. 02. 2016 21:35
Re: Součin rozpustnosti
↑ Community:
Zdravím,
záporný výsledek je taky výsledek, v tomto případě je to opravdu tak.
Rozpustnost síranů prvků IIA skupiny klesá spolu s rostoucí periodou (čím je prvek níž v tabulce, tím méně je síran rozpustný).
To, že je MgSO4 rozpustný, je zcela normální. A to, že vyšla konstanta záporně, není problém, ostatně konstanta pro disociaci kyseliny sírové na HSO4- je něco kolem -3, pro disociaci HI=H+ a I- ta konstanta činí dokonce -10!
Síran hořečnatý (mimochodem tvoří heptahydrát známý jako Epsomská sůl) se běžně používá v analytické chemii pro standardizaci roztoků chelatonu.
Doučím M, Ch v okolí Pardubic
Press any key to continue. Alt + F4?
Offline
